Abteilung Zelluläre Neurowissenschaften
Wie generiert unser Gehirn Erinnerungen an bestimmte Orte und Ereignisse? Und warum versagen unsere Gedächtnisleistungen bei neurologischen Erkrankungen?
Wir untersuchen, wie synaptische Signale durch Nervenzellen und deren Netzwerke verarbeitet werden. So wollen wir grundlegende Mechanismen der Gedächtnisbildung und deren Störungen verstehen.
Forschungsthemen
- Den neuronalen Code knacken
Den neuronalen Code knacken
Wir wollen verstehen, wie Nervenzellen im Hippocampus den neuronalen Code aus Aktionspotenzialen generieren, der dieser Region erlaubt mit der Hirnrinde und anderen Regionen zu kommunizieren. Dieser Code ist reich an Information. Er enthält Informationen über den Ort, die eigene Bewegung, die zu Grunde liegende Motivation und die Bedeutung eines Ortes oder Ereignisses. Um den Code knacken zu können, verfolgen wir synaptische Signale während des Lernverhaltens. Wir erstellen Computermodelle, die uns helfen zu verstehen und vorherzusagen, wie diese Signale zu Aktionspotenzialen umgewandelt werden. Und dann testen wir unsere Vorhersagen, indem wir die Aktionspotenziale direkt während des Verhaltens messen. (gefördert durch ERC consolidator grant SUB-D-Code) – Dennis Dalügge, Oliver Barnstedt, Pavol Bauer, Hiroshi Kaneko
- Mit Hilfe artifizieller Intelligenz Muster in neuronaler Aktivität und Verhalten erkennen
Mit Hilfe artifizieller Intelligenz Muster in neuronaler Aktivität und Verhalten erkennen
Wir verwenden maschinelles Lernen, um Verhalten genau zu klassifizieren und neuronale Aktivitätsmuster wiederzuerkennen. Das ist eine Methode, die die zelluläre Neurowissenschaft revolutionieren kann. Insbesondere erfassen wir, wie unsere Modellorganismen ihre Körperhaltung ändern und wie sie mit der Umgebung interagieren. Wir sind überzeugt, dass zeitlich hochauflösende Klassifizierung von Verhalten der erste wichtige Schritt ist, um Verhalten mit neuronaler Aktivität zu korrelieren. Der zweite wichtige Schritt ist es, aus diesen Korrelationen kausale Zusammenhänge zwischen neuronaler Aktivität und Verhalten zu erschließen. Wir nutzen also artifizielle Netzwerke, um biologische Netzwerke zu verstehen. (gefördert durch EFRE Programm- Land Sachsen-Anhalt) – Pavol Bauer, Kevin Luxem, Johannes Kürsch
- Neuronale Vielfalt verstehen
Neuronale Vielfalt verstehen
In den meisten Hirnregionen verstehen wir nicht welche Nervenzelltypen und Gruppen es gibt und welche Funktion identifizierte Zellgruppen haben. In einem Kooperationsprojekt mit Nelson Spruston (HHMI Janelia), Mark Cembrowski (Universität Vancouver) und der Janelia Quantitative Genomics Unit verwenden wir Einzell RNA-Sequenzierung und Multiplex-In-Situ-Hybridisierung um Zellgruppen auf transkriptomischer Basis zu identifizieren und deren Konnektom zu erfassen.
Die Hirnregion, die uns hier besonders interessiert ist das mediale Septum. Eine Region, die Lern- und Gedächtnisareale steuert. Wir haben ein neuartiges Konzept zur bioinformatischen Analyse von genetisch-definierbaren Zellgruppen entwickelt. In Kombination mit viralem Tracing untersuchen wir die Konnektivität spezifischer Zellgruppen mit Hippokampus und anderen Gedächtnisarealen. (gefördert durch ein HHMI Janelia Visitor Project von Stefan Remy) – Stefano Pupe - Vulnerabilität und Resilienz neuronaler Netzwerke gegenüber kognitiver Fehlfunktion
Vulnerabilität und Resilienz neuronaler Netzwerke gegenüber kognitiver Fehlfunktion
Wir erforschen, wie die Zellen und Netzwerke des Hippocampus und andereer lernrelevanter Hirnregionen auf voranschreitende pathologische Prozesse reagieren.
Hier ist liegt unser Forschungsschwerpunkt auf der Ausbreitung von Amyloid beta, das auch bei Alzheimer Patienten und im fortgeschrittenen physiologischen Alterungsprozess beobachtet wird. Wir haben mit Hilfe von Computersimulationen ein grundlegendes Prinzip beschrieben, das erklärt, warum eine Degeneration von Dendriten (den Antennen der Nervenzellen) zu Übererregbarkeit führt, die sich auf das gesamte Netzwerk überträgt. Auf Netzwerkebene untersuchen wir das Zusammenspiel von erregenden und hemmenden Prozessen. Letztere werden durch Interneurone vermittelt, Nervenzellen, die Erregung reduzieren und deren Störung zu einer Verstärkung der Netzwerk Übererregung führt. (gefördert durch DFG SFB1089 Teilprojekt B01) – Liudmila Sosulina, Hiroshi Kaneko - Verstehen wie tiefe Hirnareale Lern- und Gedächtnisprozesse modulieren
Verstehen wie tiefe Hirnareale Lern- und Gedächtnisprozesse modulieren
Tiefe Hirnareale bilden den anatomischen Kern unseres Gehirns. Sie sind an komplexen Aktivitäten wie Gedächtnis, Emotionen, Erregung und Hormonausschüttung beteiligt. Sie sind wichtige Netzwerk-Knotenpunkte, die Informationen weiterleiten und verändern. Wir versuchen besser zu verstehen, wie der Hippokampus durch verschiedene dieser Regionen, wie dem Locus coeruleus, der Ventral tegmental area und dem medialen Septum, direkt und indirekt beeinflusst wird.
Das mediale Septum ist eine Region im basalen Vorderhirn. Von dort aus steuert es die Aktivierung von hippokampalen Schaltkreisen und generiert Oszillationen in Abhängigkeit von Verhalten. Man kennt diese Region als Hauptproduzent von Acetylcholin. Ein Neurotransmitter, der über septo-hippokampale Verbindungen ausgeschüttet wird und synaptische Plastizität moduliert. Wir haben entdeckt, dass zusätzlich zu cholinergen Verbindungen auch GABAerge und insbesondere glutamaterge Verbindungen eine Schlüsselrolle bei der Steuerung des Hippokampus spielen. Wir wollen umfassend aufschlüsseln, welche Funktionen diese wichtige Schlüsselregion bei verschiedenen Verhaltensmustern innehat. (gefördert durch SFB 1089 Teilprojekt C05) – Petra Mocellin, Liudmila Sosulina
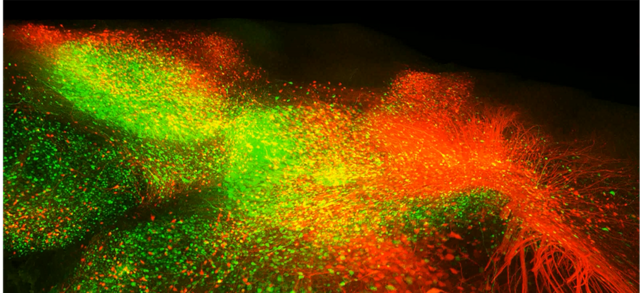
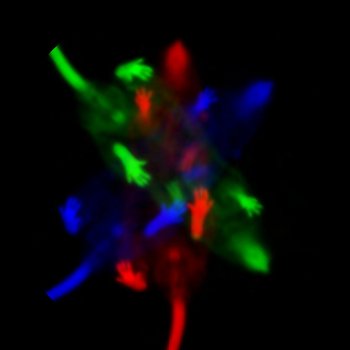
Die Filmsequenz zeigt eine 3D-Aufnahme des medialen Septums in einem Maushirn. Glutamaterge Neurone (VGluT2-positiv) sind rot markiert, grün markierte Neurone stehen mit dem medialen entorhinalen Kortex in monosynaptischer Verbindung.
Abteilung
- News
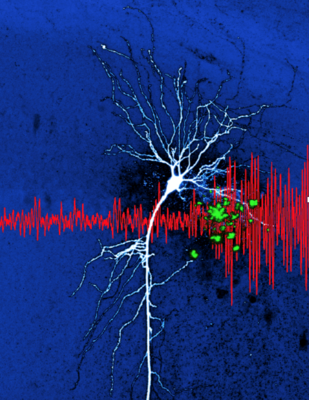
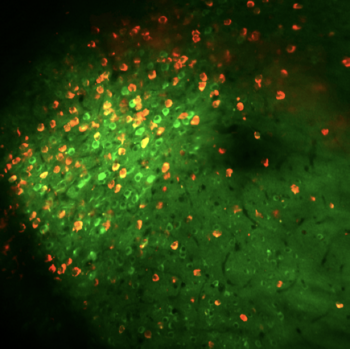
Preprint „Hippocampal hyperactivity in a rat model of Alzheimer’s disease". Diese Illustration zeigt Amyloidansammlungen (grün) in der Nähe von einer Nervenzelle des Hippokampus (CA1 Pyramidenzelle). Die Ansammlung von Amyloid beta ist ein Prozess, der bei der Alzheimer Erkrankung beobachtet wird. In mehreren Arbeiten unseres Labors (Sosulina et al. bioRxiv 2020, Siskova et al. Neuron 2014) haben wir Pathomechanismen der veränderten Nervenzellerregbarkeit beschrieben. Diese Veränderungen zeigen sich auf Netzwerkebene durch unregelmäßigere Oszillationen (hier im lokalen Feldpotenzial, rot). Preprint „Identifying Behavioral Structure from Deep Variational Embeddings of Animal Motion“ News
Neues Preprint über Mechanismen der neuronalen Übererregbarkeit und Netzwerk Dysfunktion bei Alzheimer.
Unser neues Paper ist veröffentlicht. Es entstand aus einer großartigen Zusammenarbeit mit den Laboren von Martin Fuhrmann (DZNE Bonn) und Michael Rowan (Trinity College Dublin). Liudmila Sosulina und Manuel Mittag untersuchten die Funktion von Mikronetzwerken im Hippokampus (CA1) in einem Rattenmodell der beta-Amyloidose. Sie sind die ersten, die zeigen können, dass auch im Rattenmodell (wie beim Menschen und in der Maus) eine Übererregbarkeit hippokampaler Netzwerke auftritt und zwar schon sehr früh in der Pathologieentstehung. Sie wendeten dafür das in-vivo Zweiphotonen-Kalziumimaging und Patch Clamp Verfahren an. Mechanistisch liegen diese frühen Veränderungen in den Nervenzellen selbst, ihre elektrische Erregbarkeit ist verstärkt. Erst später setzt eine Störung inhibitorischer Netzwerke ein, die bisher in anderen Modellsystemen als hauptsächlicher Pathomechanismus beschrieben war. Unsere Daten deuten darauf hin, dass zell-intrinsische Veränderungen den Netzwerkstörungen zuvor kommen könnten.
Veröffentlichung eines neuen Preprints inklusive Quellcodes
Wir freuen uns, einen neuen Preprint mit dem Titel „Identifying Behavioral Structure from Deep Variational Embeddings of Animal Motion“ zu veröffentlichen, welcher unter BioRxiv verfügbar ist. In diesem Preprint präsentieren wir ein neuartiges Framework für maschinelles Lernen zur Entdeckung der latenten Struktur des Tierverhaltens anhand von Daten aus der markerlosen Berechnung der Körperstellung, mit dem Titel Variational Animal Motion Embedding (VAME).
VAME teilt die Zeitreihendaten in „Verhaltensmotive“, bei denen es sich um stereotype Verhaltensmuster handelt, welche im freien Verhalten wiederholt auftreten. Die Struktur des Verhaltens wird dann in der Verteilung dieser Motive sowie der Übergangswahrscheinlichkeit zwischen den Modulen dargestellt. Des Weiteren zeigen wir, dass diese Informationen sensitiv genug sind, um als Grundlage für die Klassifizierung von Mäusen nach ihren Verhaltensphänotypen zu dienen. Dies kann auch bei subtilen Verhaltensunterschieden erfolgen, welche für menschliche Experten nicht aus Videoaufnahmen erkennbar sind.
- Leiter

Leiter
Seit Januar 2020 ist Stefan Remy der wissenschaftliche Direktor des LIN und leitet die Abteilung Zelluläre Neurowissenschaft. Er ist Professor für molekulare und zelluläre Neurowissenschaft an der medizinischen Fakultät der Otto-von-Guericke-Universität in Magdeburg.
Die Abteilung von Stefan Remy erforscht die grundlegenden Mechanismen von Lernen und Gedächtnis auf der Ebene der Signalverarbeitung durch Nervenzellen. In der Abteilung arbeiten Biologen, Mediziner, Mathematiker und Informatiker eng zusammen, um kausale Zusammenhänge zwischen neuronaler Aktivität und Verhalten aufzudecken.
Er promovierte im Jahr 2003 an der Universität Bonn und forschte im Anschluss als Postdoktorand bei Heinz Beck an der Klinik für Epileptologie (Direktor: Christian E. Elger). Als Alexander von Humboldt-Stipendiat schloss er sich dem Department für Neurobiologie und Physiologe an der Northwestern University in Evanston, USA, an. Dort forschte er bei Nelson Spruston an synaptischer Plastizität und neuronaler Erregbarkeit. Im Jahr 2007 setzte er seine Forschungen mit Heinz Beck in Bonn fort, dort gründete er im Jahr 2009 seine eigene Forschungsgruppe, gefördert durch das Land Nordrhein-Westfalen. Bevor er im Jahr 2020 seine neuen Aufgaben am LIN antrat, forschte er 10 Jahre als Leiter der Arbeitsgruppe „Neuronale Netzwerke“ und Programmkoordinator (Brain Function) am Deutschen Zentrum für Neurodegenerative Erkrankungen Bonn (Direktor: Pierluigi Nicotera).
There are places I remember
All my life though some have changed
Some forever not for better
Some have gone and some remain
All these places have their moments
With lovers and friends I still can recall
Some are dead and some are living
In my life I've loved them all.(John Lennon/ Paul McCartney)
Was John Lennon und Paul McCartney mit meiner Forschungsphilosophie verbindet, erkläre ich hier in meiner Antrittsrede.
- Mitglieder
Mitglieder
Leiter Prof. Dr. Stefan Remy +49 391 6263 92421, 92411, 93311 stefan.remy@lin-magdeburg.de Assistenz Juliane Jäger +49 391 6263 92411 juliane.jaeger@lin-magdeburg.de Gruppenleiter Dr. Alessio Attardo (AG Hippocampus-Plastizität und episodisches Gedächtnis)
+49 391 6263 93371 alessio.attardo@lin-magdeburg.de Prof. Dr. Stefan Remy (Cells and Circuits)
+49 391 6263 92421, 92411, 93311 stefan.remy@lin-magdeburg.de Wissenschaftliche Mitarbeiter Dr. Oliver Barnstedt (DZNE Bonn)
Dr. Stefan Dürschmid (AG Sensorisches Lernen und Prädiktion)
+49 391 6263 92431 stefan.duerschmid@lin-magdeburg.de Dr. Hiroshi Kaneko
+49 391 6263 93371 hiroshi.kaneko@lin-magdeburg.de Dr. Liudmila Sosulina
+49 391 6263 93371 liudmila.sosulina@lin-magdeburg.de Dr. Ulrich Thomas (AG Synapsengenetik)
+49 391 6263 93231 ulrich.thomas@lin-magdeburg.de Doktoranden Petra Mocellin
+49 391 6263 9 2411 petra.mocellin@lin-magdeburg.de Dennis Dalügge +49 391 6263 93361 dennis.daluegge@lin-magdeburg.de Damaris Holder
+49 391 6263 93321 damaris.holder@lin-magdeburg.de Felix Kuhn
+49 391 6263 93321 felix.kuhn@lin-magdeburg.de Kevin Luxem
+49 391 6263 93361 kevin.luxem@lin-magdeburg.de Technische Mitarbeiter und Laborservice Jorge R. Bergado Acosta +49 391 6263 93271 jorge.bergado-acosta@lin-magdeburg.de Janina Juhle +49 391 6263 93321 janina.juhle@lin-magdeburg.de Silvia Vieweg +49 391 6263 93481 silvia.vieweg@lin-magdeburg.de Studierende / Weitere Mitwirkende Dr. Falko Fuhrmann (Lab consultant)
- Publikationen
Publikationen
Ausgewählte Publikationen
Luxem K, Fuhrmann F, Kürsch J, Remy S*, Bauer P*. 2020. Identifying Behavioral Structure from Deep Variational Embeddings of Animal Motion. BioRxiv. https://doi.org/10.1101/2020.05.14.095430 * shared senior authorship
Justus D, Dalügge D, Bothe S, Fuhrmann F, Hannes C, Kaneko H, Friedrichs D, Sosulina L, Schwarz I, Elliott DA, Schoch S, Bradke F, Schwarz MK, Remy S. 2017. Glutamatergic synaptic integration of locomotion speed via septoentorhinal projections. Nature Neuroscience. 20(1):16-19. https://doi.org/10.1038/nn.4447
Schmid LC, Mittag M, Poll S, Steffen J, Wagner J, Geis HR, Schwarz I, Schmidt B, Schwarz MK, Remy S, Fuhrmann M. 2016. Dysfunction of Somatostatin-Positive Interneurons Associated with Memory Deficits in an Alzheimer's Disease Model. Neuron. 92(1):114-125. https://doi.org/10.1016/j.neuron.2016.08.034
Fuhrmann F, Justus D, Sosulina L, Kaneko H, Beutel T, Friedrichs D, Schoch S, Schwarz MK, Fuhrmann M, Remy S. 2015. Locomotion, Theta Oscillations, and the Speed-Correlated Firing of Hippocampal Neurons Are Controlled by a Medial Septal Glutamatergic Circuit. Neuron. 86(5):1253-1264. https://doi.org/10.1016/j.neuron.2015.05.001
Šišková Z, Justus D, Kaneko H, Friedrichs D, Henneberg N, Beutel T, Pitsch J, Schoch S, Becker A, vonderKammer H, Remy S. 2014. Dendritic structural degeneration is functionally linked to cellular hyperexcitability in a mouse model of alzheimer's disease. Neuron. 84(5):1023-1033. https://doi.org/10.1016/j.neuron.2014.10.024
Müller C, Beck H, Coulter D, Remy S. 2012. Inhibitory Control of Linear and Supralinear Dendritic Excitation in CA1 Pyramidal Neurons. Neuron. 75(5):851-864. https://doi.org/10.1016/j.neuron.2012.06.025
Krueppel R, Remy S, Beck H. 2011. Dendritic integration in hippocampal dentate granule cells. Neuron. 71(3):512-528. https://doi.org/10.1016/j.neuron.2011.05.043
Park JY, Remy S, Varela J, Cooper DC, Chung S, Kang HW, Lee JH, Spruston N. 2010. A post-burst afterdepolarization is mediated by group I metabotropic glutamate receptor-dependent upregulation of Cav2.3 R-type calcium channels in CA1 pyramidal neurons. PLoS Biology. 8(11):e1000534. https://doi.org/10.1371/journal.pbio.1000534
Remy S, Csicsvari J, Beck H. 2009. Activity-Dependent Control of Neuronal Output by Local and Global Dendritic Spike Attenuation. Neuron. 61(6):906-916. https://doi.org/10.1016/j.neuron.2009.01.032
Remy S, Spruston N. 2007. Dendritic spikes induce single-burst long-term potentiation. Proceedings of the National Academy of Sciences of the United States of America. 104(43):17192-17197. https://doi.org/10.1073/pnas.0707919104
Alle Publikationen der Abteilung
2023
Luxem K, Sun JJ, Bradley SP, Krishnan K, Yttri E, Zimmermann J, Pereira TD, Laubach M, Cai DJ, Colgin LL. 2023. Open-source tools for behavioral video analysis: Setup, methods, and best practices. eLife. 12:e79305. https://doi.org/10.7554/eLife.79305
Barnstedt O, Mocellin P, Remy S. 2023. A hippocampus-accumbens code guides goal-directed appetitive behavior. bioRxiv. https://doi.org/10.1101/2023.03.09.531869
Beckmann D, Langnaese K, Gottfried A, Hradsky J, Tedford K, Tiwari N, Thomas U, Fischer K-D, Korthals M. 2023. Ca2+ Homeostasis by Plasma Membrane Ca2+ ATPase (PMCA) 1 Is Essential for the Development of DP Thymocytes. International Journal of Molecular Sciences. 24(2):Article 1442. https://doi.org/10.3390/ijms24021442
Ghelani T, Escher M, Thomas U, Esch K, Lützkendorf J, Depner H, Maglione M, Parutto P, Gratz S, Matkovic-Rachid T, Ryglewski S, Walter AM, Holcman D, O'Connor Giles K, Heine M, Sigrist SJ 2023. Interactive nanocluster compaction of the ELKS scaffold and Cacophony Ca2+ channels drives sustained active zone potentiation. Science advances. 9(7):Article eade7804. https://doi.org/10.1126/sciadv.ade7804
Grochowska KM, Gomes GM, Raman R, Kaushik R, Sosulina L, Kaneko H, Oelschlegel AM, Yuanxiang P, Reyes-Resina I, Bayraktar G, Samer S, Spilker C, Woo MS, Morawski M, Goldschmidt J, Friese MA, Rossner S, Navarro G, Remy S, ... Kreutz MR. 2023. Jacob-induced transcriptional inactivation of CREB promotes Aβ-induced synapse loss in Alzheimer's disease. The EMBO journal. 42(4):Article e112453. https://doi.org/10.15252/embj.2022112453
Holder D, Prigge M. 2023. Spatial and Temporal Considerations of Optogenetic Tools in an All-Optical Single-Beam Experiment. Papagiakoumou E, editor. In All-Optical Methods to Study Neuronal Function. Humana Press Inc. pp. 165-185. (Neuromethods). https://doi.org/10.1007/978-1-0716-2764-8_6
Mittag M, Mediavilla L, Remy S, Cuntz H, Jedlicka P. 2023. Modelling the contributions to hyperexcitability in a mouse model of Alzheimer's disease. Journal of Physiology. https://doi.org/10.1113/JP283401
2022
Chenani A, Weston G, Ulivi AF, Castello-Waldow TP, Huettl R-E, Chen A, Attardo A. 2022. Repeated stress exposure leads to structural synaptic instability prior to disorganization of hippocampal coding and impairments in learning. Translational Psychiatry. 12(1):Article 381. https://doi.org/10.1038/s41398-022-02107-5
Eckert D, Reichert C, Bien CG, Heinze H-J, Knight RT, Deouell LY, Dürschmid S. 2022. Distinct interacting cortical networks for stimulus-response and repetition-suppression. Communications biology. 5(1):Article 909. https://doi.org/10.1038/s42003-022-03861-4
Krueger J, Krauth R, Reichert C, Perdikis S, Vogt S, Huchtemann T, Dürschmid S, Sickert A, Lamprecht J, Huremovic A, Goertler M, Nasuto SJ, Knight RT, Hinrichs H, Heinze H-J, Lindquist S, Sailer M, Millán JDR, Sweeney-Reed CM. 2022. Functional electrical stimulation driven by a brain–computer interface in acute and subacute stroke patients impacts beta power and long-range temporal correlation. In 2022 IEEE Workshop on Complexity in Engineering (COMPENG). IEEE. https://doi.org/10.1109/COMPENG50184.2022.9905448
Luxem K, Mocellin P, Fuhrmann F, Kürsch J, Miller SR, Palop JJ, Remy S, Bauer P. 2022. Identifying behavioral structure from deep variational embeddings of animal motion. Communications biology. 5(1):Article 1267. https://doi.org/10.1038/s42003-022-04080-7
Luxem K, Mocellin P. 2022. Self-supervised learning as a gateway to reveal underlying dynamics in animal behavior. Sprink A, Barski J, Brouwer A-M, Riedel G, Sil A, editors. In Volume 2 of the Proceedings of the joint 12th International Conference on Methods and Techniques in Behavioral Research and 6th Seminar on Behavioral Methods held online May 18-22 2022. pp. 167-170. https://doi.org/10.6084/m9.figshare.20066849.v2
Luxem K, Sun JJ, Bradley SP, Krishnan K, Yttri EA, Zimmermann J, Pereira TD, Laubach M. 2022. Open-Source Tools for Behavioral Video Analysis: Setup, Methods, and Development. arXiv. https://doi.org/10.48550/arXiv.2204.02842
Reichert C, Dürschmid S, Sweeney-Reed CM, Hinrichs H. 2022. Visual spatial attention shifts decoded from the electroencephalogram enable sending of binary messages. In 2022 IEEE Workshop on Complexity in Engineering, COMPENG 2022. IEEE. https://doi.org/10.1109/COMPENG50184.2022.9905445
2021
Kobler O, Weiglein A, Hartung K, Chen Y-C, Gerber B, Thomas U. 2021. A quick and versatile protocol for the 3D visualization of transgene expression across the whole body of larval Drosophila. Journal of Neurogenetics. 35(3):306-319. https://doi.org/10.1080/01677063.2021.1892096
Korthals M, Tech L, Langnaese K, Gottfried A, Hradsky J, Thomas U, Zenclussen AC, Brunner-Weinzierl MC, Tedford K, Fischer KD. 2021. Plasma membrane Ca2+ ATPase 1 (PMCA1) but not PMCA4 is critical for B-cell development and Ca2+ homeostasis in mice. European Journal of Immunology. 51(3):594-602. https://doi.org/10.1002/eji.202048654
Korvasová K, Ludwig F, Kaneko H, Sosulina L, Tetzlaff T, Remy S, Mikulovic S. 2021. Locomotion induced by medial septal glutamatergic neurons is linked to intrinsically generated persistent firing. bioRxiv. https://doi.org/10.1101/2021.04.23.441122
Krick N, Ryglewski S, Pichler A, Bikbaev A, Götz T, Kobler O, Heine M, Thomas U, Duch C. 2021. Separation of presynaptic Cav2 and Cav1 channel function in synaptic vesicle exo- and endocytosis by the membrane anchored Ca2+ pump PMCA. Proceedings of the National Academy of Sciences of the United States of America. 118(28):Article e2106621118. https://doi.org/10.1073/pnas.2106621118
Mocellin P, Mikulovic S. 2021. The Role of the Medial Septum-Associated Networks in Controlling Locomotion and Motivation to Move. Frontiers in neural circuits. 15:Article 699798. https://doi.org/10.3389/fncir.2021.699798
Sarkar I, Maji I, Omprakash C, Stober S, Mikulovic S, Bauer P. 2021. Evaluation of deep lift pose models for 3D rodent pose estimation based on geometrically triangulated data. CV4Animals Workshop, CVPR 2021. https://arxiv.org/abs/2106.12993
Sosulina L, Mittag M, Geis H-R, Hoffmann K, Klyubin I, Qi Y, Steffen J, Friedrichs D, Henneberg N, Fuhrmann F, Justus D, Keppler K, Cuello AC, Rowan MJ, Fuhrmann M, Remy S. 2021. Hippocampal hyperactivity in a rat model of Alzheimer's disease. Journal of Neurochemistry. 157(6):2128-2144. https://doi.org/10.1111/jnc.15323
Wachtler T, Bauer P, Denker M, Grün S, Hanke M, Klein J, Oeltze-Jafra S, Ritter P, Rotter S, Scherberger H, Stein A, Witte OW. 2021. NFDI-Neuro: Building a community for neuroscience research data management in Germany. Neuroforum. 27(1):3-15. https://doi.org/10.1515/nf-2020-0036
2020
Bertan F, Wischhof L, Sosulina L, Mittag M, Dalügge D, Fornarelli A, Gardoni F, Marcello E, Di Luca M, Fuhrmann M, Remy S, Bano D, Nicotera P. 2020. Loss of Ryanodine Receptor 2 impairs neuronal activity-dependent remodeling of dendritic spines and triggers compensatory neuronal hyperexcitability. Cell Death and Differentiation. 27(12):3354-3373. https://doi.org/10.1038/s41418-020-0584-2
Luxem K, Fuhrmann F, Kürsch J, Remy S*, Bauer P*. 2020. Identifying Behavioral Structure from Deep Variational Embeddings of Animal Motion. bioRxiv. https://doi.org/10.1101/2020.05.14.095430 * shared senior authorship
2019Schwarz MK, Remy S. 2019. Rabies virus-mediated connectivity tracing from single neurons. Journal of Neuroscience Methods. 325:108365. https://doi.org/10.1016/j.jneumeth.2019.108365
Luxem K, Fuhrmann F, Remy S,Bauer P. 2019. Hierarchical network analysis of behavior and neuronal population activity. In: 2019 Conference on Cognitive Computational Neuroscience. Berlin, Germany: Cognitive Computational Neuroscience; 2019. https://doi.org/10.32470/CCN.2019.1261-0
2018Dalügge D, Remy S. 2018. Human Cortical Dendrites: Stretched to Perform Better?. Cell. 175(3):635-637. https://doi.org/10.1016/j.cell.2018.09.052
Giovannetti E, Poll S, Justus D, Kaneko H, Fuhrmann F, Steffen J, Remy S, Fuhrmann M. 2018. Restoring memory by optogenetic synchronization of hippocampal oscillations in an Alzheimer’s disease mouse model. BioRXiv (preprint). https://doi.org/10.1101/363820
Musial TF, Molina-Campos E, Bean LA, Ybarra N, Borenstein R, Russo ML, Buss EW, Justus D, Neuman KM, Ayala GD, Mullen SA, Voskobiynyk Y, Tulisiak CT, Fels JA, Corbett NJ, Carballo G, Kennedy CD, Popovic J, Ramos-Franco J, Fill M, Pergande MR, Borgia JA, Corbett GT, Pahan K, Han Y, Chetkovich DM, Vassar RJ, Byrne RW, Matthew Oh M, Stoub TR, Remy S, Disterhoft JF, Nicholson DA. 2018. Store depletion-induced h-channel plasticity rescues a channelopathy linked to Alzheimer's disease. Neurobiology of Learning and Memory. 154:141-157. https://doi.org/10.1016/j.nlm.2018.06.004
Müller C, Geis HR, Remy S. 2018. Visually Guided Single-Cell Recordings in the Hippocampus of Awake Mice. Manahan-Vaughan D, editor. In Handbook of in Vivo Neural Plasticity Techniques. Elsevier B.V. pp. 123-134. (Handbook of Behavioral Neuroscience). https://doi.org/10.1016/B978-0-12-812028-6.00006-9
Müller C, Remy S. 2018. Septo–hippocampal interaction. Cell and Tissue Research. 373(3):565-575. https://doi.org/10.1007/s00441-017-2745-2
2017Justus D, Dalügge D, Bothe S, Fuhrmann F, Hannes C, Kaneko H, Friedrichs D, Sosulina L, Schwarz I, Elliott DA, Schoch S, Bradke F, Schwarz MK, Remy S. 2017. Glutamatergic synaptic integration of locomotion speed via septoentorhinal projections. Nature Neuroscience. 20(1):16-19. https://doi.org/10.1038/nn.4447
Remy S, Poirazi P, Papoutsi A. 2017. Introduction to the Computational Neuroscience Special Section. European Journal of Neuroscience. 45(8):998-999. https://doi.org/10.1111/ejn.13562
2016Müller C, Remy S. 2016. Slowly Building Excitement. Cell. 165(7):1568-1569. https://doi.org/10.1016/j.cell.2016.06.005
Schmid LC, Mittag M, Poll S, Steffen J, Wagner J, Geis HR, Schwarz I, Schmidt B, Schwarz MK, Remy S, Fuhrmann M. 2016. Dysfunction of Somatostatin-Positive Interneurons Associated with Memory Deficits in an Alzheimer's Disease Model. Neuron. 92(1):114-125. https://doi.org/10.1016/j.neuron.2016.08.034
2015Fuhrmann F, Justus D, Sosulina L, Kaneko H, Beutel T, Friedrichs D, Schoch S, Schwarz MK, Fuhrmann M, Remy S. 2015. Locomotion, Theta Oscillations, and the Speed-Correlated Firing of Hippocampal Neurons Are Controlled by a Medial Septal Glutamatergic Circuit. Neuron. 86(5):1253-1264. https://doi.org/10.1016/j.neuron.2015.05.001
Wagner J, Krauss S, Shi S, Ryazanov S, Steffen J, Miklitz C, Leonov A, Kleinknecht A, Göricke B, Weishaupt JH, Weckbecker D, Reiner AM, Zinth W, Levin J, Ehninger D, Remy S, Kretzschmar HA, Griesinger C, Giese A, Fuhrmann M. 2015. Reducing tau aggregates with anle138b delays disease progression in a mouse model of tauopathies. Acta Neuropathologica. 130(5):619-631. https://doi.org/10.1007/s00401-015-1483-3
2014Müller C, Remy S. 2014. Dendritic inhibition mediated by O-LM and bistratified interneurons in the hippocampus. Frontiers in Synaptic Neuroscience. 6(SEP):23. https://doi.org/10.3389/fnsyn.2014.00023
Pothmann L, Müller C, Averkin RG, Bellistri E, Miklitz C, Uebachs M, Remy S, de la Prida LM, Beck H. 2014. Function of inhibitory micronetworks is spared by Na+ channel-acting anticonvulsant drugs. Journal of Neuroscience. 34(29):9720-9735. https://doi.org/10.1523/JNEUROSCI.2395-13.2014
Qi Y, Klyubin I, Harney SC, Hu NW, Cullen WK, Grant MK, Steffen J, Wilson EN, Do Carmo S, Remy S, Fuhrmann M, Ashe KH, Cuello AC, Rowan MJ. 2014. Longitudinal testing of hippocampal plasticity reveals the onset and maintenance of endogenous human Aß-induced synaptic dysfunction in individual freely behaving pre-plaque transgenic rats: Rapid reversal by anti-Aß agents. Acta neuropathologica communications. 2(1):175. https://doi.org/10.1186/s40478-014-0175-x
Šišková Z, Justus D, Kaneko H, Friedrichs D, Henneberg N, Beutel T, Pitsch J, Schoch S, Becker A, vonderKammer H, Remy S. 2014. Dendritic structural degeneration is functionally linked to cellular hyperexcitability in a mouse model of alzheimer's disease. Neuron. 84(5):1023-1033. https://doi.org/10.1016/j.neuron.2014.10.024
2013Müller C, Remy S. 2013. Fast micro-iontophoresis of glutamate and GABA: a useful tool to investigate synaptic integration. Journal of visualized experiments: JoVE. (77). https://doi.org/10.3791/50701
2012Müller C, Beck H, Coulter D, Remy S. 2012. Inhibitory Control of Linear and Supralinear Dendritic Excitation in CA1 Pyramidal Neurons. Neuron. 75(5):851-864. https://doi.org/10.1016/j.neuron.2012.06.025
2011Krueppel R, Remy S, Beck H. 2011. Dendritic integration in hippocampal dentate granule cells. Neuron. 71(3):512-528. https://doi.org/10.1016/j.neuron.2011.05.043
Chen S, Su H, Yue C, Remy S, Royeck M, Sochivko D, Opitz T, Beck H, Yaari Y. 2011. An increase in persistent sodium current contributes to intrinsic neuronal bursting after status epilepticus. Journal of Neurophysiology. 105(1):117-129. https://doi.org/10.1152/jn.00184.2010
2010Park JY, Remy S, Varela J, Cooper DC, Chung S, Kang HW, Lee JH, Spruston N. 2010. A post-burst afterdepolarization is mediated by group I metabotropic glutamate receptor-dependent upregulation of Cav2.3 R-type calcium channels in CA1 pyramidal neurons. PLoS Biology. 8(11):e1000534. https://doi.org/10.1371/journal.pbio.1000534
Remy S, Beck H, Yaari Y. 2010. Plasticity of voltage-gated ion channels in pyramidal cell dendrites. Current Opinion in Neurobiology. 20(4):503-509. https://doi.org/10.1016/j.conb.2010.06.006
2009Remy S, Csicsvari J, Beck H. 2009. Activity-Dependent Control of Neuronal Output by Local and Global Dendritic Spike Attenuation. Neuron. 61(6):906-916. https://doi.org/10.1016/j.neuron.2009.01.032
2008Royeck M, Horstmann MT, Remy S, Reitze M, Yaari Y, Beck H. 2008. Role of axonal NaV1.6 sodium channels in action potential initiation of CA1 pyramidal neurons. Journal of Neurophysiology. 100(4):2361-2380. https://doi.org/10.1152/jn.90332.2008
2007Remy S, Spruston N. 2007. Dendritic spikes induce single-burst long-term potentiation. Proceedings of the National Academy of Sciences of the United States of America. 104(43):17192-17197. https://doi.org/10.1073/pnas.0707919104
2006Remy S, Beck H. 2006. Molecular and cellular mechanisms of pharmacoresistance in epilepsy. Brain. 129(Pt 1):18-35. https://doi.org/10.1093/brain/awh682
Heinemann U, Kann O, Remy S, Beck H. 2006. Novel mechanisms underlying drug resistance in temporal lobe epilepsy. Advances in neurology. 97:85-95.
2005Yue C, Remy S, Su H, Beck H, Yaari Y. 2005. Proximal persistent Na+ channels drive spike afterdepolarizations and associated bursting in adult CA1 pyramidal cells. Journal of Neuroscience. 25(42):9704-9720. https://doi.org/10.1523/JNEUROSCI.1621-05.2005
2004Remy C, Remy S, Beck H, Swandulla D, Hans M. 2004. Modulation of voltage-dependent sodium channels by the δ-agonist SNC80 in acutely isolated rat hippocampal neurons. Neuropharmacology. 47(7):1102-1112. https://doi.org/10.1016/j.neuropharm.2004.06.034
2003Ellerkmann RK, Remy S, Chen J, Sochivko D, Elger CE, Urban BW, Becker A, Beck H. 2003. Molecular and functional changes in voltage-dependent Na+ channels following pilocarpine-induced status epilepticus in rat dentate granule cells. Neuroscience. 119(2):323-333. https://doi.org/10.1016/S0306-4522(03)00168-4
Remy S, Urban BW, Elger CE, Beck H. 2003. Anticonvulsant pharmacology of voltage-gated Na+ channels in hippocampal neurons of control and chronically epileptic rats. European Journal of Neuroscience. 17(12):2648-2658. https://doi.org/10.1046/j.1460-9568.2003.02710.x
Remy S, Gabriel S, Urban BW, Dietrich D, Lehmann TN, Elger CE, Heinemann U, Beck H. 2003. A novel mechanism underlying drug resistance in chronic epilepsy. Annals of Neurology. 53(4):469-479. https://doi.org/10.1002/ana.10473
- Methoden
Methoden
Unser Paradigma zur Klassifikation von Mausverhalten (VAME) macht sich maschinelles Lernen zu Nutze um einzelnen Verhaltensmotive in Videoaufnahmen zu erkennen. Die Videokamera nimmt die Maus aus der Bodenperspektive durch eine Glasfläche auf. 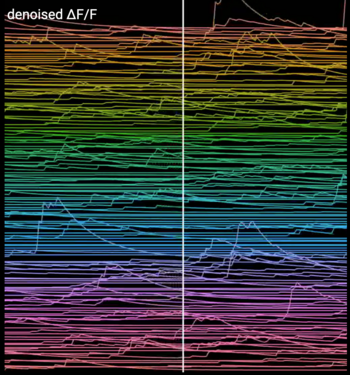
Diese Messspuren spiegeln die Veränderungen der intrazellulären Kalziumkonzentration in einer Nervenzellpopulation des Hippokampus wieder. In diesen 2-Photonen-mikroskopischen Aufnahmen können Aussagen über die neuronale Aktivität getroffen werden, da jedes neuronale Aktionspotenzial zu einer Erhöhung der intrazellulären Kalziumkonzentration führt. 
Das Bild zeigt einen der Verhaltensmessplatz zur räumlichen Gedächtnistestung in Kombination mit Zweiphotonenmikroskopie, die wir in unserem Labor verwenden. 
©Fuhrmann et al. NEURON: In einer virtuellen Realität können Mäuse räumliche Lern- und Gedächtnistests durchführen während sie sich in der Umgebung bewegen, die auf den Bildschirmen dargestellt wird. - Laufende Drittmittelprojekte
Laufende Drittmittelprojekte
Projekte der Abteilung werden unterstützt vom:
- Open Science
Open Science
public data of the department
- Der Datensatz umfasst ausführliche elektrophysiologische Charakterisierungen von Zelltypen im medialen entorhinalen Kortex (Schicht 2/3)
- Dieser GitHub Repository beinhaltet den Code zum VAME framework sowie die Dokumentation und Beispieldaten: Variational Animal Motion Embedding (VAME)