Nervenzellen kommunizieren aktiv miteinander, doch wie werden Kommunikationssignale innerhalb der Zellen weitergeleitet? Dr. Anna Karpova und Dr. Michael R. Kreutz untersuchten gemeinsam mit Kollegen in Hamburg, Cambridge und Magdeburg, dass eine Struktur, die eigentlich für Abbauprozesse und Abtransport zuständig ist, auch Signalmoleküle zu aktiven Synapsen transportieren kann und damit direkt zu aktivitätsabhängigen synaptischen Veränderungen beiträgt – also quasi ein joint venture zwischen Hauspost, Versorgung und Entsorgung zugleich. Diese Arbeiten wurden im Journal „Nature Communications“ publiziert und von den Magdeburger Neurowissenschaftlern zur besten Publikation gewählt.
Bei der Kommunikation zwischen Nervenzellen spielen Signalmoleküle, wie das BDNF und sein Rezeptor TrkB eine wichtige Rolle. Solche Signale müssen ins Innere der Zelle durchstellt werden, wo sie die Genexpression im Zellkern regulieren, was sowohl in der neuronalen Entwicklung als auch in reifen Nervenzellen eine wichtige Rolle spielt. Um solche Signale aus der Präsynapse in den Zellkern zu leiten, müssen die Signal-haltigen Vesikel im Axon transportiert werden.
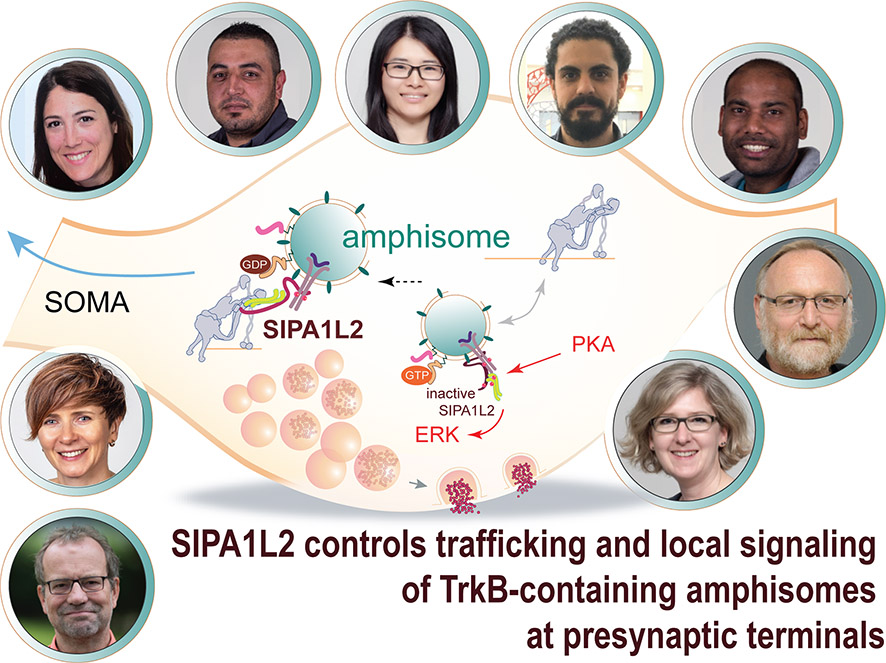
Anna Karpova und Michael R. Kreutz konnten mit ihren Kollegen zeigen, dass dieser Transport in speziellen Vesikeln, den Amphisomen, stattfindet. Hierbei handelt es sich um Hybrid-Organellen, die enstehen, wenn Endosomen mit der äußeren Membran von Autophagosomen fusionieren. Autophagie erlaubt es Zellen, eigene Bestandteile abzubauen und zu verwerten. Das reicht von fehlgefalteten Proteinen bis zu ganzen Zellorganellen. Überraschenderweise organisieren Neurone Aufnahme und Abbau solcher Entsorgungsfracht räumlich getrennt. In Axonen werden Proteine aufgenommen und im Zellkörper in Lysoomen abgebaut. Diese Trennung erlaubt es nun, dass Autophagie auch eine Rolle bei der neuronalen Signalgebung spielen kann.
Das Forschungsteam hat herausgefunden, dass Amphisomen auf ihrem Weg vom Axon zum Soma an präsynaptischen Nervenendigungen plastische Prozesse regulieren, die die Effizienz der synaptischen Neurotransmission erhöhen. Vermutlich gleichzeitig räumen sie „Proteinmüll“ ab und transportieren sowohl Signalmoleküle wie das BDNF-TrkB-Duo als auch „beschädigte“ Proteine. Bei der punktgenauen Kontrolle dieser Prozesse kommt das Regulator-Protein SIPA1L2 ins Spiel. Wenn es in Mäusen ausgeschaltet wird, dann werden diese Transportprozesse gestört, wodurch die Tiere schlechter lernen können.
Diese überraschende Entdeckung zeigt, wie Nervenzellen die negativen Konsequenzen ihrer enormen Ausdehnung, die vor allem eine Herausforderung für den Erhalt ihrer Membranen darstellt, auf elegante Weise gelöst haben. Membranprozesse, die sich gegenseitig nicht stören, können in den gleichen Vesikeln stattfinden.
CBBS-Paper of the year
Diese Publikation ist in diesem Jahr von den Mitgliedern des Center for Behavioral Brain Sciences (CBBS) zum „Best Paper of the Year“ gewählt worden.
Das CBBS ist der Zusammenschluss aller Magdeburger Neurowissenschaftler. Es ermöglicht eine Förderung besonders innovativer und zukunftsweisender Forschungsvorhaben im Rahmen der Neurowissenschaften und zeichnet jährlich die Best Paper of The Year aus.
Das CBBS wurde 2007 gegründet und integriert die Erforschung von Lernen und Gedächtnis, von physiologischen und pathophysiologischen Prozessen der Hirnplastizität, der Neuromodulation und der Kognition mit seinen Methodik- und Technologie-Plattformen.
Preisträgerin Dr. Anna Karpova
Dr. Anna Karpova ist wissenschaftliche Mitarbeiterin in der Forschungsgruppe Neuroplastizität unter der Leitung von Michael R. Kreutz. Sie hat an der Bashkir State University in Ufa Biologie und Chemie studiert. Anschließend promovierte sie in Neurowissenschaften. Seit 2008 ist sie als wissenschaftliche Mitarbeiterin in der Forschungsgruppe Neuroplastizität am Leibniz-Institut für Neurobiologie Magdeburg tätig. Aktuell ist die Wissenschaftlerin als Co-Projektleiterin mit Michael R. Kreutz an Projekten zur Synapsen-Kern-Kommunikation tätig.
Das Paper ist verfügbar unter https://www.nature.com/articles/s41467-019-13224-z