Combinatorial NeuroImaging Core Facility
Das Combinatorial NeuroImaging (CNI) Gerätezentrum am Leibniz-Institut für Neurobiologie Magdeburg vereinigt ein breites Spektrum an Bildgebungstechnologien für nicht-invasive Human-Bildgebung, translationales Kleintier-Imaging und hochauflösende Lichtmikroskopie.
Unser Ziel ist es, als Forschungsinfrastruktur und Dialogplattform interne und externe Nutzer bestmöglich wissenschaftlich zu betreuen und sie mit hoher Effizienz und Expertise bei ihren Forschungsvorhaben zu unterstützen.
Der wissenschaftliche Anspruch des CNI liegt in der Kombination der verschiedenen Technologien, um ganzheitliche Ansätze insbesondere in der Lern- und Gedächtnisforschung zu befördern und von der molekularen bis zur systemischen Ebene zu einem umfassenden Verständnis dieser Prozesse zu kommen. Diesen integrativen Ansatz bezeichnen wir als „Combinatorial NeuroImaging“.
Forschungsinfrastruktur
- Mikroskopie
Die Core Facility Combinatorial NeuroImaging bietet freien Zugang zu State-of-the-Art Mikroskopen, die ein großes Spektrum bildgebender Verfahren unterstützen. Wir bieten hochauflösende STED-Mikroskopie, Lichtblattmikroskopie, Weitfeldmikroskopie, FLIM und Konfokalmikroskopie. Mit Unterstützung der EFRE-Förderung entstand ein neues Bildgebungslabor für die 2-Photonen-Mikroskopie in sich verhaltenden Tieren. Darüber hinaus unterstützen wir die Bildverarbeitung und -analyse mit professionellen Softwarepaketen, die auf Server-Arbeitsplätzen bzw. einem zentralen Processing Server mit Remote-Zugriff laufen.
Wir arbeiten eng zusammen mit der German BioImaging-Gesellschaft für Mikroskopie und Bildanalyse e.V und dem Multi-parametric bioimaging and cytometry (MPBIC) Gerätezentrum an der Universität Magdeburg.
Hochauflösende MikroskopieInverses Leica TCS STED-SP8 3X
Stimulated emission depletion microscopy

- hochauflösendes Mehrkanal-STED in 3D
- Mehrkanal-Konfokalmikroskopie
- Live-Cell-Imaging
- Tile-Scan-Imaging
KonfokalmikroskopieAufrechtes Leica TCS SP8

- Mehrkanal-Konfokalmikroskopie
- Tile-Scan-Imaging
WeitfeldfluoreszenzmikroskopieLeica Thunder Imager

- Mehrkanal-Weitfeldmikroskopie
- Hellfeld- sowie Fluoreszenzmikroskopie
- mit computational clearing
Multi-Photonen-Mikroskopieverschiedene 2-Photonen-Mikroskope
Behavioral Bioimaging Core Unit

- funktionelles Imaging der neuronalen Aktivität mittels In-vivo-Zwei-Photonen Mikroskopie
- In-vivo-Imaging von Mäusen auf einem Laufband
- zusätzliche Aufzeichnung von Verhaltens- und physiologischen Metadaten
LichtblattmikroskopieMiltenyi Blaze

- 3D-Mehrkanal-Imaging von großen Präparaten (Larven, Organe, adulte Maus)
- sowohl Live-Imaging als auch fixierte und geklärte Präparate (Brechungsindices von 1.33 bis 1.56)
- LightSpeed Scan Mode und MACS IQ 3D Bildbearbeitungssoftware (Deconvolution, Destriping etc.)
Leica SP8-Digital LightSheet Microscope

- schnelles subzelluläres Imaging, live und fixiert
- Multikanal-3D-FLIM-Imaging
AnalysesoftwareFür die Bildverarbeitung und -analyse werden im LIN folgende Softwarepakete genutzt:
- Huygens Professional
kommerzielle Dekonvolierungs- und Bildanalysesoftware - Imaris
kommerzielle dreidimensionale Bildanalysesoftware - Arivis Vision 4D + InViewR
kommerzielle dreidimensionale Bildanalysesoftware + virtuelle Realität - ImageJ / Fiji
Open-Source-Bildanalysesoftware - MACS IQ 3D
kommerzielle Bildverarbeitungssoftware
Diese sind zur multiplen Nutzung u.a. auf einem Hive Processing Server installiert.
- Kleintierbildgebung
Die Tierbildgebung stellt ein entscheidendes Bindeglied zwischen Mikroskopie und Human-Bildgebung dar. Mit den verfügbaren Bildgebungstechniken (MRT, SPECT/CT, PET) sind systemische Untersuchungen, wie am Menschen möglich. Darüber hinaus bietet sich aber im Tierversuch die Möglichkeit der Kombination mit invasiven Verfahren in-vivo. So erlaubt die ‚molekulare Bildgebung‘ Rückschlüsse über physiologische Prozesse auf molekularer Ebene. Hinsichtlich der mechanistischen Aufklärung neuronaler Prozesse ist die Kombination mit pharmakologischen und elektrophysiologischen Methoden besonders aufschlussreich.
Die Combinatorial NeuroImaging Core Facility bietet Anwendern Zugang zu Kleintierbildgebungs-Labors mit einem 9,4 Tesla Kernspintomographen, einem SPECT/CT System und einem PET Scanner. Die Labore bieten die Option der sequentiellen Kombination der verschiedenen Modalitäten am selben Tier.
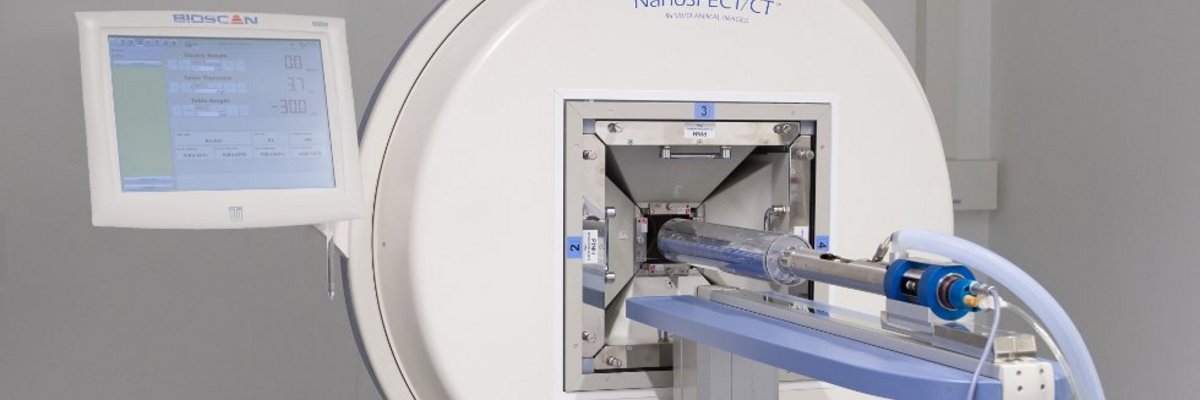
PET und SPECT/CTDas Kleintier-In-vivo-Radionuklid-Bildgebungslabor ist ausgerüstet mit einem Philips Mosaic-PET-Scanner und einem NanoSPECT/CT-Scanner (Bioscan/Mediso). PET und SPECT ermöglichen die Visualisierung der Biodistribution radioaktiv markierter Substanzen. Mit dem SPECT-System am CNI sind isotrope räumliche Auflösungen von unter 500 µm erreichbar. Klassische Einsatzgebiete dieser Verfahren sind die Bildgebung von Hirnstoffwechsel und Hirnaktivität, von Neurotransmittersystemen und Rezeptorverteilungen sowie die Untersuchung neurodegenerativer und neuroinflammatorischer Prozesse.

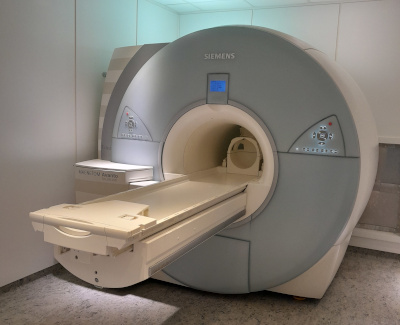
9,4 Tesla Kleintier-MagnetresonanztomographSeit 2018 hat das LIN einen Hochfeld-Magnetresonanztomographen (Bruker BioSpec 94/20 UHF). Dieses Gerät ist mit einer Kryospule zur hochauflösenden Bildgebung mit exzellentem Signal-zu-Rausch-Verhältnis und mit einer Vielzahl anderer RF-Spulen ausgestattet, die sich zur Kombination magnetresonanztomographischer Untersuchungen (Anatomie, funktionelle Bildgebung, Spektroskopie, Diffusions- und Perfusionsbildgebung) mit optogenetischen, elektrophysiologischen, pharmakologischen u.ä. Versuchsansätzen an Nagetieren eignen.
- Humanbildgebung
Die neurowissenschaftliche Forschung an Menschen ist aus ethischen Gründen im Wesentlichen auf nicht-invasive Methoden beschränkt. Durch stetige Innovationen in der Bildgebungstechnologie und in der Bildanalyse werden jedoch immer detailliertere Einblicke in das menschliche Gehirn möglich.
Hauptziel technologischer Entwicklungen ist es, immer höhere räumliche und zeitliche Auflösungen zu erzielen und durch die gleichzeitige Kombination von fMRT mit EEG sowie Systemen zur Aufzeichnung von Psychophysiologie und Verhalten möglichst umfangreiche Erkenntnisse über die neuronalen Prozesse im Gehirn zu gewinnen. Die Core Facility Combinatorial NeuroImaging bietet Anwendern offenen Zugang zu folgenden Laboren:
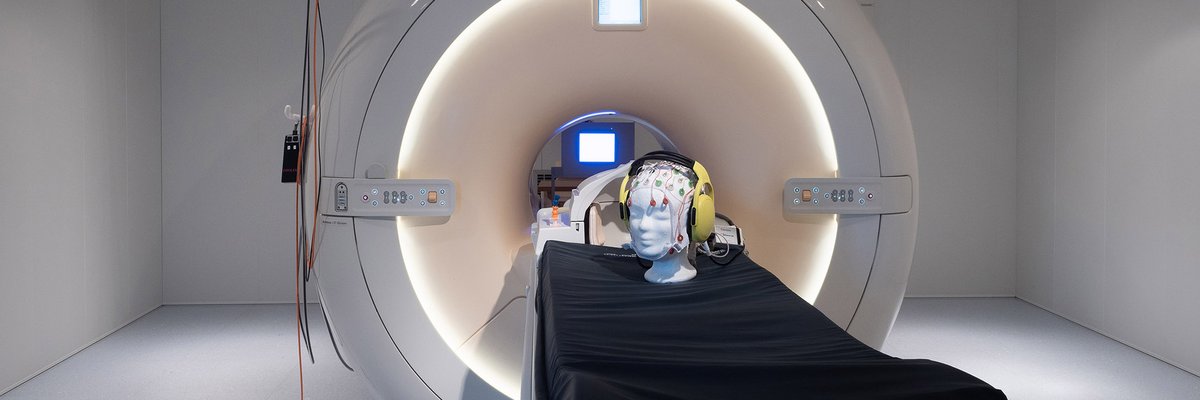
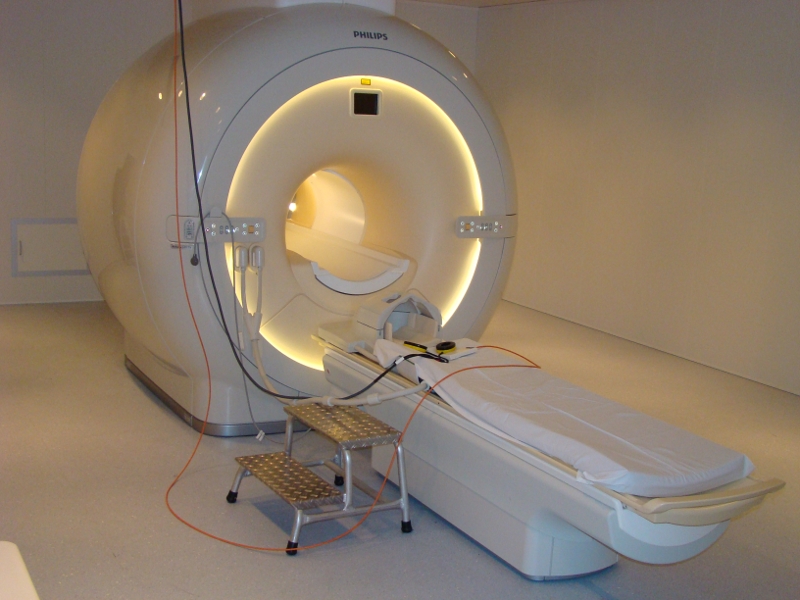
3 Tesla KernspintomographDas aus Mitteln des Landes Sachsen-Anhalt sowie dem Europäischen Fonds für regionale Entwicklung (EFRE) finanzierte Philips 3T Achieva dStream wurde im November 2013 in Betrieb genommen. Neben gängigen Methoden für multiparametrische anatomische Bildgebung eignet sich der Scanner insbesondere für Ganzkopf fMRT (2 mm isotrope Auflösung) und gleichzeitiger hochsynchroner und artefakt-reduzierter Erfassung von EEG Signalen (64-Kanal-System mit Carbon-Wire-Loop-Technologie). Das Labor zeichnet sich durch zahlreiche Zusatzsysteme zur Erfassung von Atmung, Puls, Hautleitfähigkeit, Mimik, Pupillengröße, Eye-Tracking und Tastendruckdynamik aus. Ausführliche Informationen zur technischen Ausstattung am Scanner finden Sie unter MRI-WIKI. Wenn Sie unser MRT-Labor nutzen, beachten Sie bitte auch unsere Laborordnung.
ElektroenzephalographieMittels Elektroenzephalographie (EEG) lässt sich die Aktivität von Nervenzellen im Gehirn anhand der von ihnen erzeugten Ströme elektrisch geladener Teilchen (u.a. Natrium und Kalium) mit einer sehr hohen zeitlichen Auflösung von ca. einer Millisekunde erfassen. Dabei wird die durch den Stromfluss erzeugte Verteilung des elektrischen Potentials auf der Kopfoberfläche mittels spezieller Elektroden gemessen. In unserem Labor stehen hierfür mehrere EEG-Systeme, darunter ein aktives 128-Kanal-System, zur Verfügung.
Darüber hinaus können EEG-Messungen auch mit multiplen peripheren physiologischen Mess- und Stimulationsmethoden kombiniert werden. Multikanal-Elektromyographie, d.h. die Messung von elektrischer Muskel-Aktivität, Hautwiderstandsmessung, Atembewegungserfassung und Elektrokardiographie werden zur Erfassung emotionaler Zustände herangezogen; ebenso können Augenbewegungen sowie otoakustische Emissionen erfasst werden. Eine direkte Modulation der Gehirnaktivität ist durch transkraniale Elektrostimulation möglich.

AkustikkammerFür psychoakustische Untersuchungen von Probanden betreibt das CNI eine Akustikkammer. Hierzu gehören die audiometrische Bestimmung der Hörschwelle mittels Madsen Itera II von Otometrics, die Charakterisierung grundlegender auditorischer Fähigkeiten mittels Brain-Boy von Medi-TECH sowie des Sprachverständnisses mittels „Oldenburger Messprogramme“ von HörTech.



Mock ScannerCNI bietet Zugang zu einem nachgebildeten MRT-Scanner, in dem realistischer Scannerlärm abgespielt sowie akustische und visuelle Stimuli präsentiert werden können. Der Scanner kann genutzt werden, um Probanden an die MRT-Umgebung zu gewöhnen, um Aufgaben für spätere fMRT Studien zu trainieren und den Schwierigkeitsgrad anzupassen, der möglicherweise durch das Liegen auf dem Rücken in einem engen und lauten MRT-Scanner beeinträchtigt wird.
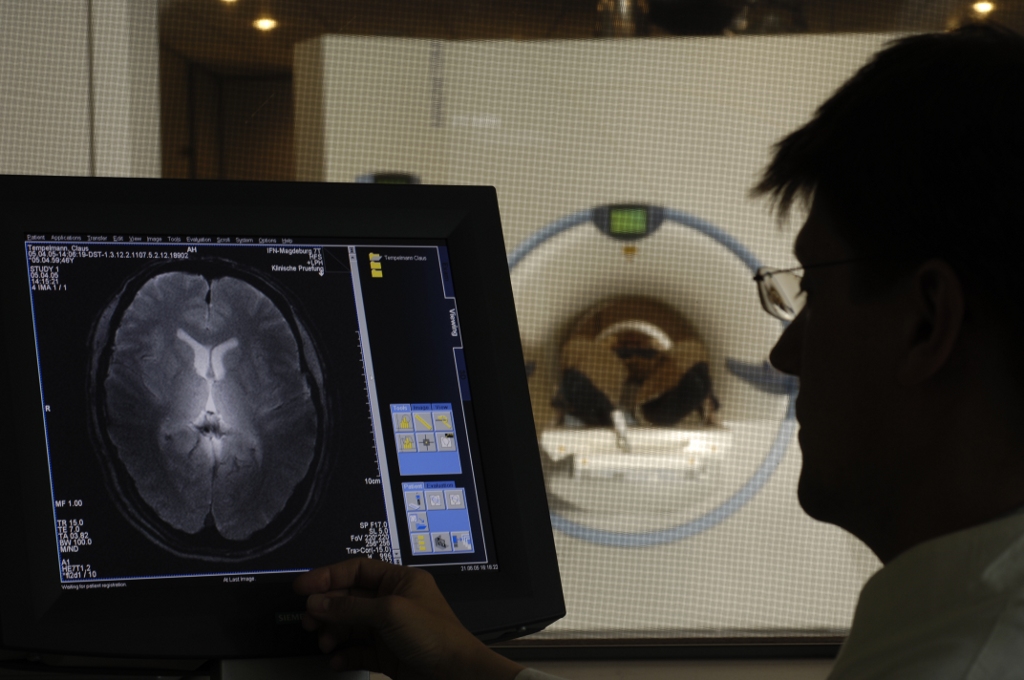
7 Tesla KernspintomographDas Leibniz-Institut für Neurobiologie hat 2004 Europas ersten 7 Tesla Kernspintomographen (MRT) für Untersuchungen am Menschen in einem eigens dafür errichteten Gebäude in direkter Nachbarschaft zum Hauptgebäude installiert und bis 2021 betrieben. 2022 wurde das Gerät an die OVGU übertragen, steht jedoch weiterhin wie gewohnt für die Nutzung zur Verfügung.
Das stärkere Magnetfeld führt im Vergleich zum 3 Tesla MRT zu einem gut doppelt so starken Signal (bzw. Signal-Rausch-Verhältnis). Dieses erhöhte Signal kann genutzt werden, um die räumliche Auflösung um den gleichen Faktor zu erhöhen. Damit können kleinere Strukturen des Gehirns sowohl anatomisch als auch funktionell untersucht werden. Das stärkere Signal kann aber auch verwendet werden, um die notwendige Messzeit einer Untersuchung zu verkürzen, was insbesondere für Lernstudien von Vorteil ist.

- Studienanmeldung
Studienanmeldung
Ablauf
Für die Durchführung einer Studie an den Geräten des CNI ist die vorliegende Studienanmeldung auszufüllen. Das Formular wird anschließend als PDF zum Download/Drucken angeboten. Bitte lassen Sie uns das unterschriebene Formular per Post (CNI, Brenneckestr. 6, 39118 Magdeburg), Fax (0391/626392589) oder persönlich zukommen.
Nach interner Evaluierung der Studienanmeldung gemäß den in der Nutzerordnung angegebenen Kriterien erhalten Sie eine Rückmeldung, ob die Studie durchgeführt werden kann, wer Ihr(e) Ansprechpartner sind und wann das Projekt beginnen kann.
Nutzerordnung
Grundlage für die Arbeit des CNI ist unsere Nutzerordnung.
Änderungen laufender Studien
Eine erneute Studienanmeldung ist erforderlich, wenn
die Messzeit um mehr als 10 % der veranschlagten Messzeit über- oder unterschritten wird,
sich die Finanzierung der Messzeit ändert, insbesondere bei Überschreitungen,
eine neue Fragestellung bearbeitet werden soll,
es Änderungen bei den Projektverantwortlichen gibt.
Forschungsschwerpunkte
- Stoffwechselaktivität auf Zell- und Systemebene
Neuronale sowie gliale Aktivität und Metabolismus sind eng miteinander verbunden. Mit zunehmender Aktivität nehmen die Ionenbewegungen über Mitochondrien- und Zellmembranen sowie der Glukose- und Sauerstoffverbrauch zu. Veränderungen im neuronalen und glialen Stoffwechsel lösen Veränderungen im lokalen Blutfluss aus.
Innerhalb des CNI verwenden wir verschiedene makroskopische, mesoskopische und mikroskopische Imaging-Techniken zur Darstellung des neuronalen und zerebralen Metabolismus, um Muster neuronaler Aktivität aufzudecken, die mit Lern- und Gedächtnisprozessen sowie neurodegenerativen Erkrankungen verbunden sind.
Um den Zusammenhang zwischen neuronaler Aktivität und Stoffwechselzustand zu untersuchen, beobachten wir:
- Veränderungen der Durchblutung, des Glukoseverbrauchs und des Sauerstoffmetabolismus mit SPECT, PET und fMRI
- Veränderungen des Kaliumumsatzes mittels SPECT-Bildgebung und histochemischem Nachweis des K+-Sonden-Thalliums (Tl+)
- die Intensität und Fluoreszenzlebensdauer von intrinsischen Coenzymen (z.B. NADH und FAD) in lebenden neuronalen Zellkulturen
- Ca2+-Imaging und pH-Änderungen
Metabolic Imaging auf zellulärer Ebene (Weber, Zuschratter)
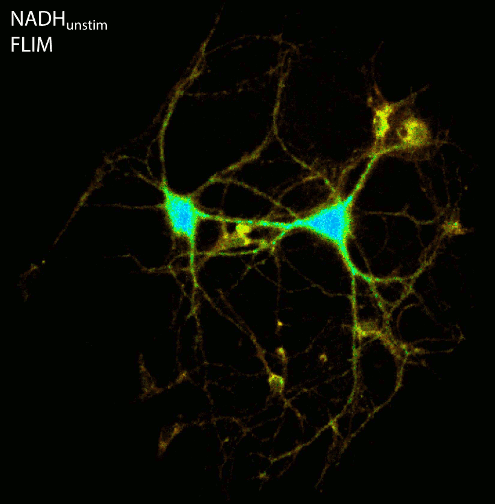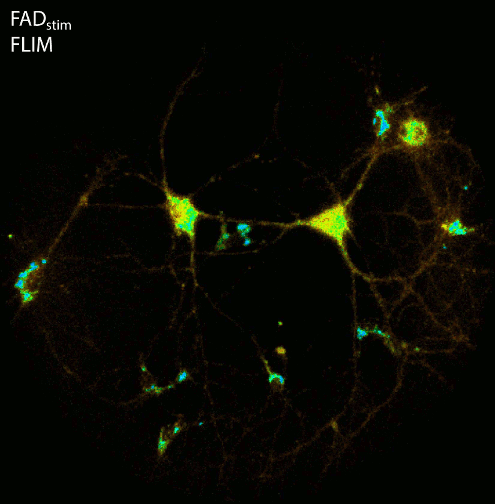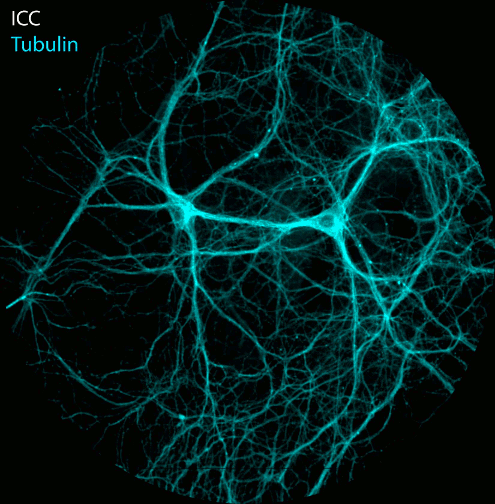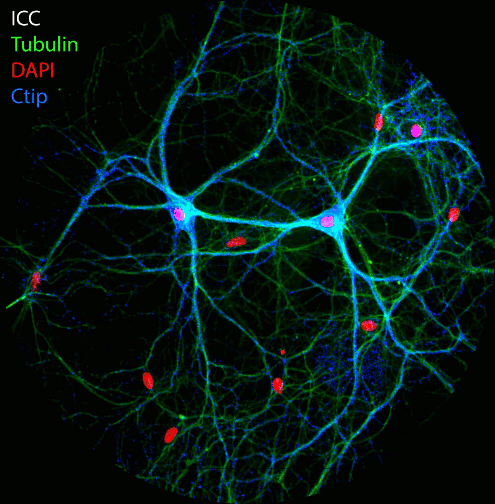
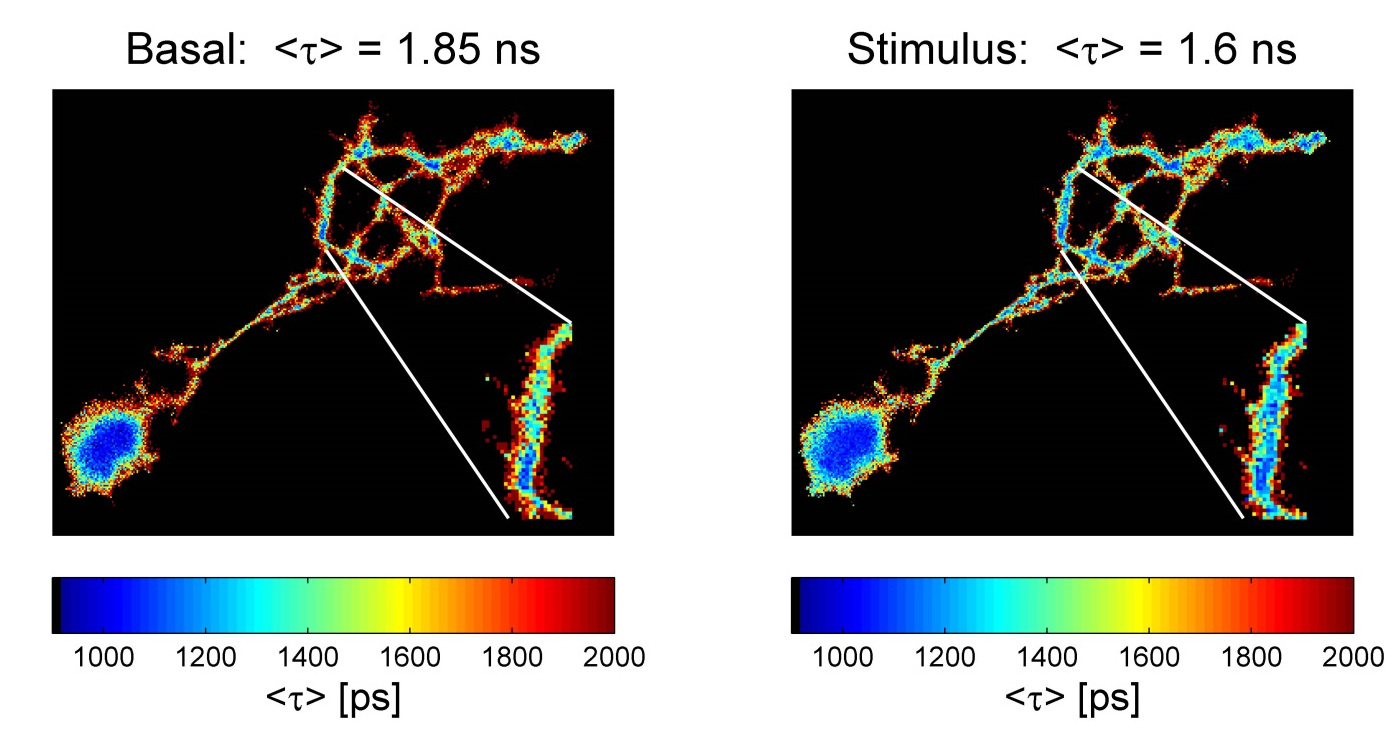
Die zelluläre Energieerzeugung in Form von ATP hängt von der Elektronentransportkette innerhalb der Mitochondrien ab. In einem ersten Schritt dieser komplexen Kette wird NADH, das intrinsisch fluoresziert (z. B. 355 nm, em. 460 nm), zum nicht fluoreszierenden NAD+ oxidiert. Die Messung der Fluoreszenzlebensdauer von NADH liefert Informationen über die Mikroumgebung des Coenzyms, da unterschiedliche zelluläre Bedingungen das Verhältnis zwischen gebundenem und ungebundenem NADH verändern. Da freies NADH im Vergleich zu proteingebundenem NADH eine wesentlich kürzere Fluoreszenzlebensdauer aufweist, kann FLIM verwendet werden, um verschiedene Stoffwechselzustände einer Zelle wie Hunger, Sauerstoffmangel oder höhere Aktivität (z.B. bei zellulärem Stress oder Entzündungen) zu unterscheiden.
Mit der hochempfindlichen LINCam (im Single-Photon Counting Modus) untersuchen wir die komplexe Beziehung zwischen Energiestoffwechsel und elektrischer Aktivität neuronaler Zellkulturen. Dazu beobachten wir die Autofluoreszenz von NAD(P)H und FAD über Stunden unter extrem geringen Beleuchtungsverhältnissen in Kombination mit elektrischer Stimulation oder Aufnahme der elektrischen Aktivität über Multi-Elektrodenarrays. Nach der Burst-Aktivität zeigt der Energieverbrauch von Neuronen eine vorübergehende Verringerung der NADH-Fluoreszenzintensität sowie eine Erhöhung der Fluoreszenzlebensdauer, was darauf hinweist, dass hauptsächlich freies NADH des Zytoplasmas zum nicht fluoreszierenden NAD+ oxidiert wird, während protein- bzw. enzymgebundenes NADH persistiert.
Da NADH in fast allen Zellen als intrinsischer, nicht-invasiver Fluoreszenzmarker fungiert, der die Erforschung der Stoffwechseldynamik lebender Zellen ermöglicht, besteht ein großes Interesse daran, das Redoxpaar NAD+ / NADH und die Fluoreszenzlebensdauereigenschaften von NADH nicht nur für die Erforschung des Energieumsatzes in Bezug auf die neuronale Aktivität zu nutzen, sondern auch für die medizinische Diagnostik (z.B. Neuroinflammation). Daher werden wir in Zukunft auf Basis der LINCam weitere empfindliche Werkzeuge zur Analyse des Zusammenhangs zwischen Energieversorgung und zellulärem Verhalten entwickeln.
Abbildung: Die Aufnahme der NAD(P)H- und FAD-Fluoreszenz in neuronalen Zellkulturen zeigt Änderungen der Fluoreszenzintensität und der Fluoreszenzlebensdauer nach elektrischer Stimulation. Nach der Lebendbeobachtung wurden die Zellkulturen fixiert und mit Antikörpern gegen Tubulin, Dapi und den Transkriptionsfaktor Ctip2 immungefärbt. FLIM- und konfokale Bildaufnahme durch Ezgi Altun.
Förderung:- DFG SFB 854 TPZ
- BMBF T-CAM4Life FKZ: 13N12675
Kollaborationspartner:- LIN: Altun, E., Herrera-Molina, R., Kobler, O., Prokazov, Y., Thomas, U., Turbin, E.
- OvGU: Arens, Ch., Davaris, N., Hartig, R., Hauser, M., Müller, A., Sabel, B., Vollmer, M., Walles, H.
- MPI Magdeburg: Ivanov, I.
- Univ. Mainz: Bikbaev, A., Heine, M.
FLIM- und FRET-Messungen (Weber, Herrera-Molina, Zuschratter)
Das CNI führt FLIM-basierte FRET-Messungen an Biosensoren durch, um Protein-Protein-Wechselwirkungen durch Einzelphotonenzählung mit der LINCam zu bewerten. Zusätzlich untersuchen wir Biosensoren, die uns Auskunft über die Konzentration biologisch relevanter Ionen, wie z.B. Calcium (Ca2+) und Protonen (H+), bei Änderungen des Membranpotentials und des intrazellulären pH-Werts aufgrund neuronaler Aktivität geben können.
Abbildung: Fluoreszenz-Lifetime-Analyse von pH-Änderungen in kultivierten Neuronen mit dem pH-Sensor (eGFP-pHsens). Linkes Bild: Lifetime Imaging vor Stimulation; rechtes Bild: Reaktion auf eine robuste Stimulation (KCN, 200 uM). Die Ausschnittvergrößerung eines dendritischen Segments zeigt, wie sich die Fluoreszenzlebensdauer aufgrund eines verringerten pH-Werts ändert.
Kollaborationspartner:- National: Friederich, T. (TU Berlin)
- Magdeburg: Hartig, R., Müller, A., Schraven, B., Simioni, L. (Med Fac. OvGU)
- LIN: Gundelfinger, ED., Thomas, U.
Förderung:- DFG CRC 854 TPZ
- BMBF TCAM4Life (FKZ: 13N12675)
Funktionelles 2-Photonen-In-vivo-Imaging neuronaler Aktivität des Hippocampus (Fuhrmann, Bauer, Remy)
Der Hippocampus ist an der Kodierung episodischer Erinnerungen beteiligt, und die neuronale Aktivität des Hippocampus korreliert mit der räumlichen Information, der eigenen Bewegung, der Motivation und der Bedeutung, die sich aus Vorerfahrungen ergeben und unter Krankheitsbedingungen verändern. Wir verwenden In-vivo-Zwei-Photonen-Mikroskopie in Kombination mit genetisch codierten Indikatoren (z.B. genetisch codierten Calcium-Indikatoren, GCaMPs), um neuronale Schaltkreise des Hippocampus in Verhaltensversuchen an wachen Mäusen zu untersuchen. Diese Methode ermöglicht es, exakt die räumlich-zeitlichen Aktivitätsmuster zu messen, genetisch markierte Subpopulationen zu identifizieren und subzelluläre Kompartimente in kopffixierten Mäusen, die räumliche Verhaltensaufgaben auf einem linearen Laufband ausführen, dauerhaft zu beobachten.
Video: GCamP6-Ausprägung im Hippocampus mit zusatzlich markierten PV-Intraneuronen (rot).Video: Aufzeichnung der Hippocampus-Aktivität (GCamP6) während der Fortbewegung.Bildgebung des zerebralen Blutflusses und Kalium-Stoffwechsels (Goldschmidt)
Während der vergangenen Jahrzehnte sind zahlreiche Methoden für die Bildgebung neuronaler Aktivität entwickelt worden, aber es ist nach wie vor schwierig, die Aktivitätsmuster im gesamten Hirn von Nagetieren im ungestörten Verhalten zu erfassen. Wir haben neue Ansätze und Protokolle entwickelt, um dieses Problem zu adressieren. Unsere Methoden basieren darauf, Tieren im Verhalten Tracer-Substanzen zur Bildgebung von zerebralem Blutfluß und K+-Stoffwechsel intravenös zu injizieren. Dabei handelt es sich um Tracer, deren Verteilung im Hirn nach der Injektion ausgelesen werden kann, entweder in vivo mithilfe der Single-Photon Emissions-Computertomographie (SPECT) oder histochemisch in Hirnschnitten. Einen der verwendeten Tracer, den lipophilen Chelatkomplex Thallium Diethyldithiocarbamat (TlDDC), haben wir patentieren lassen für die Bildgebung des zerebralen K+-Stoffwechsels. Mit unseren neuen Ansätzen erhalten wir Bilder hirn-weiter räumlicher Aktivitätsmuster - gemittelt über Zeitspannen von wenigen Minuten - von frei beweglichen Tieren im Verhalten. Die Techniken sind nicht nur von großem Nutzen bei der Untersuchung von Lern- und Gedächtnis-Vorgängen, sondern auch zur Bildgebung pathologischer Veränderungen in Maus-Modellen neurologischer oder psychiatrischer Erkrankungen.
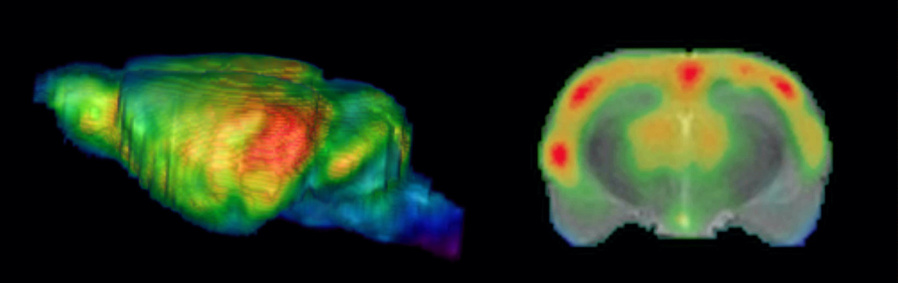
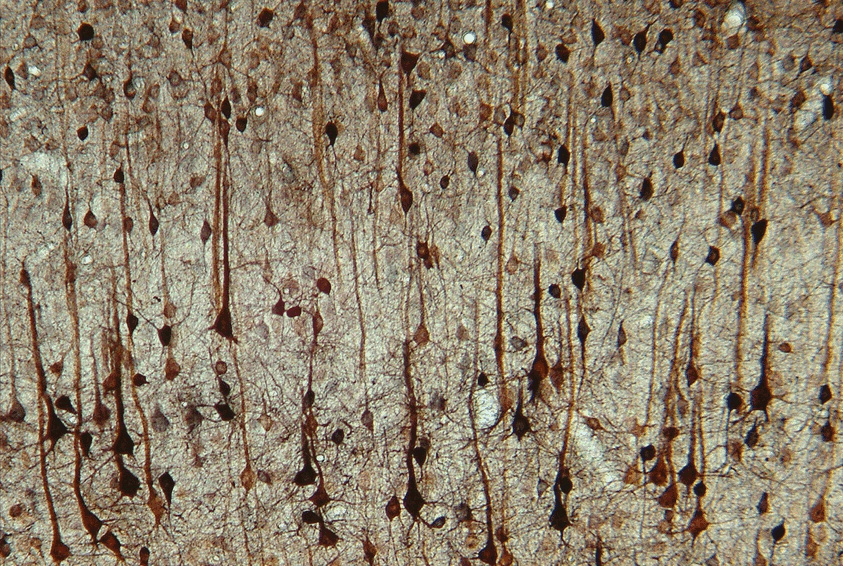 Abbildung: SPECT-Bilder des Blutflusses im Gehirn einer Ratte während einer auditorischen Lernaufgabe. Links die Seitenansicht auf ein volumen-gerendertes 3D-Ganzhirn-Bild des zerebralen Blutflusses, rechts eine Schicht in der Frontalebene auf der Höhe des auditorischen Cortex überlagert auf ein MR-Bild (MR-Bild in Graustufen, SPECT pseudocoloriert).Abbildung: Thallium-Aufnahme in Schicht IV und V im somatosensorischen Cortex einer Ratte.
Abbildung: SPECT-Bilder des Blutflusses im Gehirn einer Ratte während einer auditorischen Lernaufgabe. Links die Seitenansicht auf ein volumen-gerendertes 3D-Ganzhirn-Bild des zerebralen Blutflusses, rechts eine Schicht in der Frontalebene auf der Höhe des auditorischen Cortex überlagert auf ein MR-Bild (MR-Bild in Graustufen, SPECT pseudocoloriert).Abbildung: Thallium-Aufnahme in Schicht IV und V im somatosensorischen Cortex einer Ratte. - Funktionelle Neuroanatomie
Translationale Neuromodulation (Deliano)
Ziel unserer Forschungsaktivitäten ist es, die Hirndynamik über Gehirn-Maschine-Schnittstellen (BMIs) zu modulieren, und damit pathologische Zustände zu unterdrücken. Darüber hinaus beabsichtigen wir die Hirnnetzwerke plastisch so zu verändern, dass pathologische Zustände auch nachhaltig beseitigt werden ohne die Notwendigkeit einer dauerhaften Neuromodulation. In einer engen translationalen Zusammenarbeit mit Lars Büntjen vom Universitätsklinikum der OvGU untersuchen wir allgemeine Prinzipien der Neuromodulation. Wir nutzen dazu Analysen hoch-dichter EEG/MEG-Ableitungen von Patienten mit wohldefinierten pathologischen Zuständen, die mit Hilfe von tiefer Hirnstimulation oder Rückenmarksstimulation behandelt werden. Wir greifen dabei auf unsere langjährige Expertise in der thalamokortikalen Neurodynamik, und ihrer pharmakologischen und elektrischen Modulation in Nagern und Menschen zurück. Als Hubs im thalamokortikalen Netzwerk sehen wir Schicht-V-Pyramidenzellen als gemeinsames Ziel verschiedener Formen klinischer Neuromodulation an. Insbesondere sind diese Zellen Hauptziele dompaminerger Modulation und stellen niederschwellige Sweet-Spots der Elektrostimulation dar. Darüber hinaus sind sie vermutlich an thalamokortikalen Oszillationen beteiligt, die sich im EEG/MEG bei verschiedenen neuropsychiatrischen Erkrankungen beobachten lassen. Erste Ergebnisse in Patienten, die mit SCS gegen neuropathischen Schmerz behandelt werden, bestätigen den Zusammenhang zwischen thalamokortikalen EEG-Oszillationen und den Wirkungen und Nebenwirkungen der SCS.
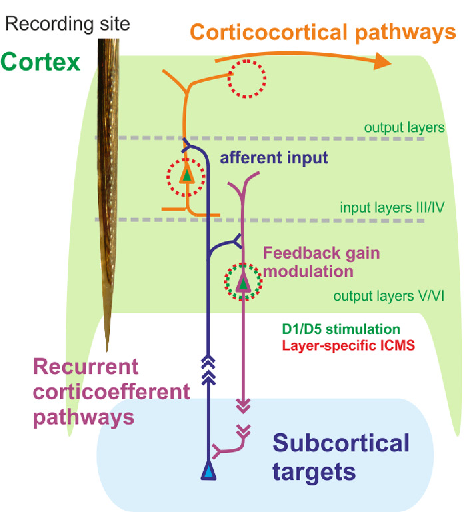 Abbildung: Schichtspezifische kortikothalamische Grenzfläche
Abbildung: Schichtspezifische kortikothalamische GrenzflächeKollaborationspartner:
- Max Happel, AG CortXplorer, Abteilung Systemphysiologie des Lernens
- Lars Büntjen, Klinik für stereotaktische Neurochirurgie, OvGU Universitätsklinikum
Hemisphäreninteraktionen beim auditorischen Lernen (Angenstein, Budinger, Michalek, Wenk)
Der linke und rechte auditorische Kortex sind unterschiedlich auf die Verarbeitung von bestimmten spektralen und zeitlichen Parametern spezialisiert (z.B. Frequenz, Dauer), was z.B. zur Dominanz der linken Hemisphäre bei der Verarbeitung von Sprache und spezies-spezifischen Kommunikationssignalen führt. Langjährige Forschungen am LIN haben gezeigt, dass bei Menschen und Tieren ähnliche Mechanismen diesen lateralisierten Hörkortexfunktionen zugrunde liegen, es ist jedoch noch immer unklar, wie die beiden Hemisphären bei der auditorischen Verarbeitung und insbesondere beim auditorischen Lernen interagieren. Außerdem ist noch nicht gut verstanden, wie sich die Hemisphäreninteraktionen ändern, wenn ihre anatomischen Grundlagen (Corpus callosum, anteriore Kommissur) zunehmend gestört werden bzw. wie derartige Störungen kompensiert werden können. Mithilfe eines Tiermodells für das auditorische Lernen (Mongolische Wüstenrennmaus), Go/No-Go Verhaltensparadigmen, der selektiven Apoptose interhemisphärischer Projektionsneurone und der funktionellen Magnetresonanztomographie (fMRT) unter binauralen Stimulationsbedingungen (inklusive der kontralateralen Rauschmethode) zielt dieses Projekt darauf, Effekte gestörter Hemisphäreninteraktionen während des auditorischen Lernens zu untersuchen. Dabei kann die Identifikation kompensatorischer Mechanismen zu neuen Therapieansätzen für die Rehabilitation von (z.B. älteren) Patienten mit gestörten Hemisphäreninteraktionen oder einseitigen Hirnläsionen (z.B. Tumoren) führen.
Förderung:
- LIN Spezial Projekt 2018 "Crosstalk between hemispheres during auditory learning: Disturbance and compensation"
Funktionelle Anatomie des Gehirns bei Gesundheit und Krankheit (Akter, Bhattacharjee, Budinger, Goldschmidt, Wenk)
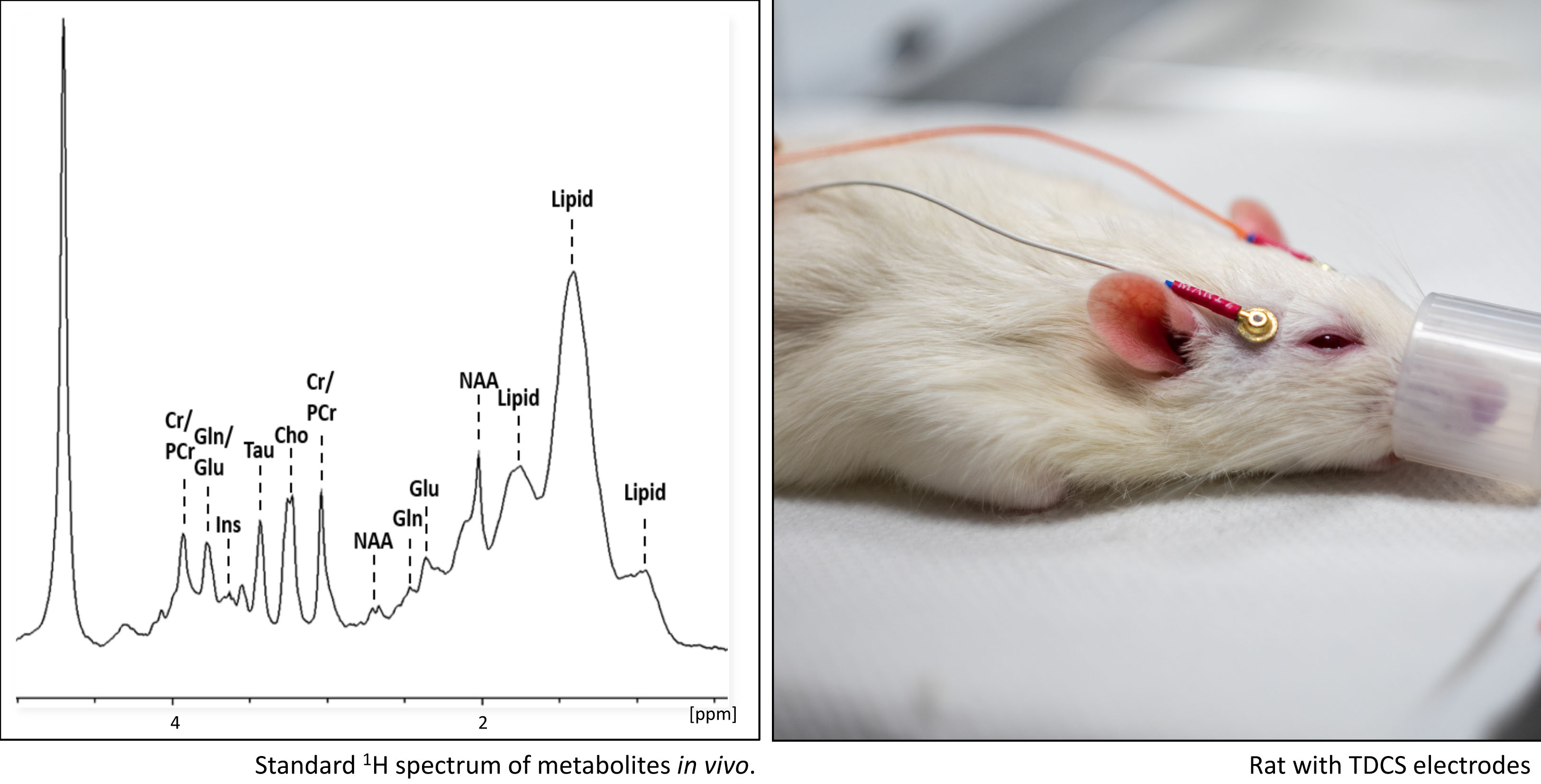
Sowohl neuroentzündliche als Infektionskrankheiten als auch zerebrale Malaria und Toxoplasmose als auch neuronale Degenerationskrankheiten wie Parkinson und Alzheimer führen oft zu schwerwiegenden Veränderungen in der Hirnstruktur und -funktion. In zahlreichen Projekten, bei denen wir hochmoderne immunhistologische Färbetechniken und nicht-invasive Methoden der Kleintierbildgebung wie SPECT (Einzelphotonen-Emissions-Computertomographie), MRT (Magnetresonanztomographie) und MRS (Magnetresonanzspektroskopie) miteinander kombinieren, untersuchen wir die diversen Krankheitsverläufe und kausalen Zusammenhänge zwischen anatomischen Veränderungen des Gehirns und spezifischen Dysfunktionen. Wir testen auch verschiedene therapeutische Ansätze wie pharmakologische Interventionen und nicht-invasive TDCS (transkranielle Gleichstromstimulation).
Kollaborationspartner:
- Lisa Carius, Institut für Automatisierungstechnik, Otto-von-Guericke Universität Magdeburg
- Philipp Ruhnau, Klinik für Neurologie, Otto-von-Guericke Universität Magdeburg
- Dirk Schlüter, Nishanth Gopola, Institute für Medizinische Mikrobiologie und Krankenhaushygiene, Medizinische Hochschule Hannover
Förderung:
- ABINEP - Analysis, Imaging, and Modelling of Neuronal and Inflammatory Processes; Project 2 (Modul 1): Development of new techniques for visualization of neuroinflammatory processes during infections and autoimmunity diseases of the brain.
- CBBS NeuroNetzwerk "Non-invasive Deep Brain Stimulation for Motor Disorders (NeeMo)"
Superresolution-Mikroskopie (Kobler, Zuschratter)
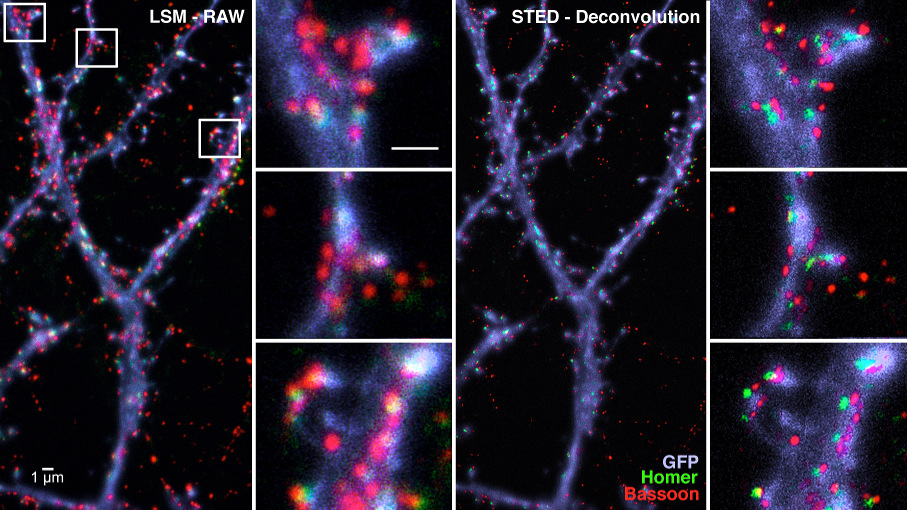
Mikroskopie jenseits der Beugungsgrenze hat in den letzten Jahren einen enormen Schub erfahren, und es wurden viele Anstrengungen unternommen, um die Auflösungsgrenze auf wenige Zehntel Nanometer zu verbessern. Dabei wird die Tatsache genutzt, dass Fluorophore wiederholt zwischen einem On- und einem Off-Zustand geschaltet werden können. Im CNI werden diese hochauflösenden lichtmikroskopischen Techniken hauptsächlich verwendet, um Kolokalisationen von Proteinen der molekularen Maschinerie auf beiden Seiten der synaptischen Kontakte zu entdecken (siehe: Hradsky J., et al. 2013; Fidzinski P., et al. 2015; Mikhaylova, M., et al., 2018).
Abbildung: Immunzytochemische Lokalisierung von prä- und postsynaptischen Proteinen Bassoon (rot) und Homer (grün) entlang der Dendriten (blau) von Hippocampus-Zellkulturen durch konfokale (LSM) und STED-Mikroskopie.Metallinduzierter Energietransfer (MIET) (Weber, Prokazov, Zuschratter)
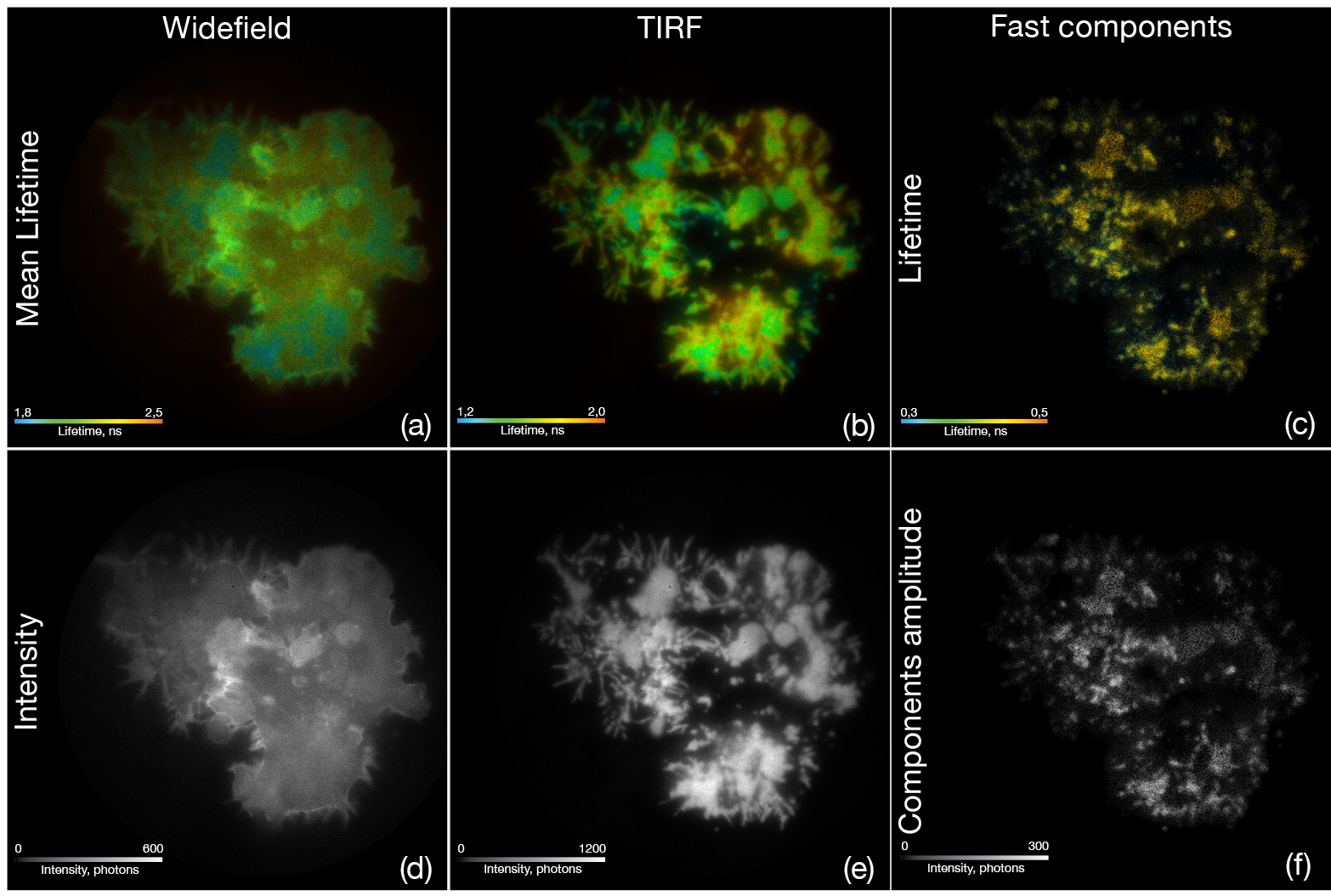
Metallinduzierter Energietransfer (MIET) ist eine Nanoskopietechnik zur Messung der z-Abstände von fluoreszierenden Molekülen zu einem Metallfilm. Dabei verwenden wir Fluoreszenzlebensdauer-Imaging-Mikroskopie (FLIM) in Kombination mit Weitfeld- oder TIRF-Beleuchtung und einem positionsempfindlichen Einzelphotonenzählkamerasystem (LINCam), um z.B. die Clusterbildung von T-Zellrezeptoren in der Plasmamembran von Lymphozyten zu untersuchen.
Abbildung: Mit GFP-Lck transfizierte T-Lymphozyten wurden mit einer Schicht CD3-Antikörper auf goldbeschichteten Deckgläsern fixiert. Unter Standardbedingungen der Epifluoreszenzbeleuchtung (a, d) zeigen die T-Zellen nach Anregung mit einem gepulsten 488-nm-Laser die typische Lebensdauer und Intensität für GFP. Das Umschalten auf TIRF-Beleuchtung (b, e) ergibt einen viel höheren Lebensdauerkontrast im Zusammenhang mit dem MIET-Effekt in der Nähe der Goldbeschichtung. Unter Verwendung einer Maximum-Entropie-Methode (MEM) zur Unterscheidung von Fluoreszenzlebensdauerkomponenten erkennt man, dass die Komponenten mit schneller Lebensdauer von 0,38 ns und 0,82 ns typische Cluster der Proteinkinase (c, f) entlang der Plasmamembran nach T- Zellrezeptorstimulation durch die CD3-Antikörper bilden.
Kollaborationspartner:- International und national: Y. Ma, K. Gauss, UNSW Sydney, J. Enderlein, Univ. Göttingen
- Magdeburg: Hartig, R., Kaestle, M., Müller, A., Philipsen, L., Schraven, B., Simeoni, L., (Med Fac. OvGU)
- LIN: Gundelfinger, E. D., Herrera-Molina, R., Thomas, U.
Förderung:- DFG: ZU 59/10-2
- DFG SFB 854 TPZ 01
- EU CORBEL NETWORK: PID 2376
Lichtblatt-Mikroskopie (Kobler)
Neben der hochauflösenden Mikroskopie ist die 3D-Visualisierung markierter Strukturen in intaktem transparentem Gewebe ein zentrales Thema des CNI. Zu diesem Zweck entwickeln wir in Zusammenarbeit mit der Abteilung Genetik von Lernen und Gedächtnis (B. Gerber, T. Saumweber), der Abteilung Neurochemie und Molekularbiologie (U. Thomas) und der Kleintierbildgebungsgruppe von CNI (E. Budinger) Protokolle zur optimalen Klärung von Drosophila-Larven und Nagetiergehirnen und erstellen 3D-Aufnahmen in einer Größenordnung von 50-400 GB durch konfokale oder Lichtblattmikroskopie.
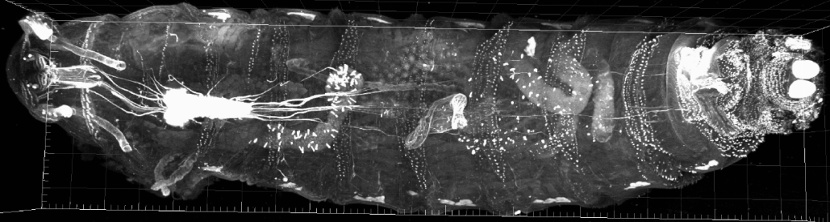
Abbildung: Eine ganze Drosophila melanogaster L3-Larve, die UAS-CAAX-mCherry pan neural exprimiert, wurde geklärt, zahlreiche Fokusebenen in Form optischer Schnitte sequentiell aufgenommen und in 3D rekonstruiert. Das 38,5-GByte-Bild besteht aus 52 Kacheln mit jeweils 707 Z-Slices. Kooperation mit B. Gerber, T. Saumweber (Abteilung Genetik von Lernen und Gedächtnis, LIN)Elektronenmikroskopie (Faber-Zuschratter, Stöter, Zuschratter)
Die korrelative hochauflösende Licht- und Elektronenmikroskopie (CLEM), die Elektronenmikroskopie großer Flächen (Large scale EM) sowie Kryo-EM und 3D-FIB-SEM sind leistungsstarke Werkzeuge, um strukturelle und funktionelle Veränderungen auf ultrastruktureller Ebene aufzuklären.
Innerhalb des CNI verwenden wir CLEM- und 3D-FIB-SEM-Techniken zur:
- Analyse von Veränderungen in synaptischen Profilen von Hirngewebe oder Zellkulturen
- Erforschung der molekularen Organisation und Dynamik der Immunsynapse (IS)
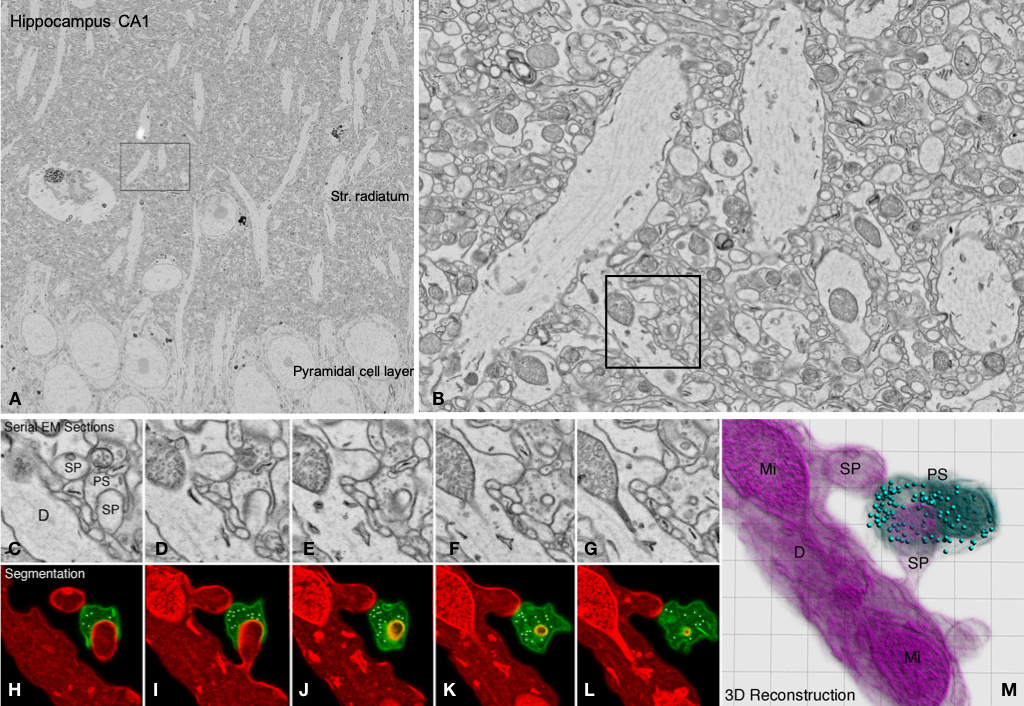
Abbildung: Übersicht und Ausschnitte aus einer Serie ultradünner Schnitte des Hippocampus (CA1) einer Maus. Die Bilder zeigen Fokusebenen aus 21 seriellen 70 nm dicken Schnitten mit einer Speichergröße von jeweils 500 MB (Gesamtgröße des Stapels: 10,5 GB). A: Übersicht; B: ROI vom Stratum radiatum in A; C-G: Details von synaptischen Kontakten entlang eines Dendriten einer Pyramidenzelle von CA1 aus B; H-L: Segmentierung von prä- und postsynaptischen Elementen; M: 3D-Rekonstruktion aus H-L.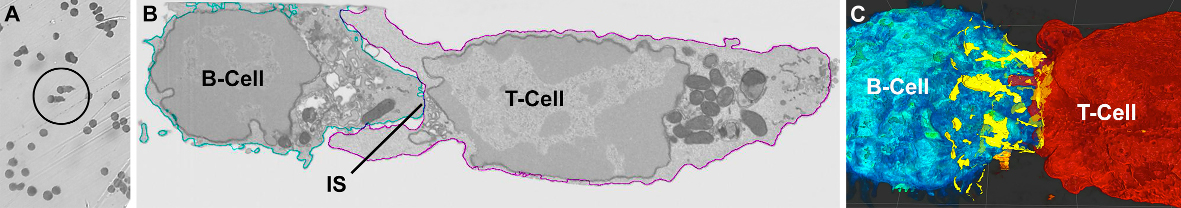
Abbildung: Korrelierte licht- (A) und elektronenmikroskopische Aufnahme (B) eines identifizierten B-T-Zellpaars. EM-Aufnahmen wurden mit einem Rasterelektronenmikroskop (REM) gemacht, das mit einem fokussierten Ionenstrahl (FIB) ausgestattet war und Serienbilder durch die Immunzellen mit einer isotropen Voxelgröße von 5 nm ermöglicht. (C) Kontaktpunkte zwischen den B-T-Zellmembranen entlang der Immunsynapse (gelb) wurden identifiziert und 3D rekonstruiert.
Da das CNI selbst keine Elektronenmikroskope besitzt, die Serienschnitte durchführen können, werden die notwendigen Imaging Techniken (z.B. 3D Rasterelektronenmikroskopie (REM)) von kooperierenden Gerätezentren an der Univers Zürich, Utrecht und am EMBL Heidelberg zur Verfügung gestellt. Letztere gehören zu dem europäischen CORBEL Netzwerk, das Shared Services für die Lebenswissenschaften durch Reisestipendien für CNI-Mitglieder fördert.Kollaborationspartner:
- International und national: Bulitta, B., Jäntsch, L. (HZI Braunschweig), Lindenau, J. (Carl Zeiss Microscopy, Oberkochen), Ronchi, P., Schwab, Y., (EMBL Heidelberg), Kaech, A., Mateos, J., Ziegler, U. (University Zürich), Liv, N., Klumperman, J., (Univ. Med. Center Utrecht)
- Magdeburg: Hartig, R., Kaestle, M., Müller, A., Philipsen, L., Schraven, B., Simeoni, L., (Med Fac. OvGU)
- LIN: Gundelfinger, E. D., Herrera-Molina, R., Thomas, U.
Förderung:- DFG: ZU 59/10-2
- DFG SFB 854 TPZ 01
- EU CORBEL NETWORK: PID 2376
- Dynamik von Lernen & Kognition
Neuronale, psychophysiologische und verhaltensbasierte Dynamik von Feedback-Lernen (Lommerzheim, Wolff, Angenstein, Stadler, Brechmann)
Tutorielle Systeme in einer Lernumgebung sollen den Nutzer beim Erreichen seines spezifischen Lernziels unterstützen und dabei auf seinen Wissensstand und seine individuellen Fähigkeiten in pädagogisch sinnvoller Weise eingehen. Hierfür ist eine umfassende Nutzermodellierung erforderlich, die neben den Vorkenntnissen des Nutzers auch die Interaktionshistorie und den augenblicklichen affektiven Zustand des Nutzers berücksichtigt. In unserem Forschungsvorhaben fokussieren wir auf eine interaktive Lernaufgabe, in welcher der Nutzer durch eine tutorielle Systemkomponente unterstützt wird. Zeitsynchron werden neurophysiologische Parameter (fMRT, EEG), psychophysiologische Merkmale (EKG, Hautleitwert, Atmung) sowie Verhaltensdetails (Tastendruckdynamik, Mimik) erfasst, um auftretende Änderungen affektiver und kognitiver Nutzerzustände mittels multimodaler Datenanalyse abzuleiten. Die interdisziplinäre Analyse und Interpretation der Zusammenhänge zwischen den teils schwachen Signalen einzelner Modalitäten und die Entwicklung und Optimierung von Klassifikatoren zur multimodalen Affekterkennung sind die primären Ziele unseres Forschungsvorhabens.
Kollaborationspartner:
- Friedhelm Schwenker, Institut für Neuroinformatik, Universität Ulm
Förderung:- DFG DFG BR 2267/9-1 "Multimodale Affekterkennung im Verlaufe eines tutoriellen Lernexperiments"
Hirnmechanismen der Informationsverarbeitung in Dialogen (Wolff, Angenstein, Brechmann)Interaktionen mit technischen Systemen werden von Seiten des Menschen als Dialog aufgefasst. Jede Aktion des Systems stellt hierbei ein Feedback auf die vorherige Handlung des Nutzers dar, der diese für zielorientierte Handlungen in folgenden Interaktionsschritten nutzt und hinsichtlich der Intentionalität des Gegenübers interpretiert. Neurowissenschaftlich sind diese dynamischen Prozesse im Zusammenspiel mit der wechselseitigen Anpassung des Verhaltens und Ableitung von Intentionen und Zielen des Gegenübers noch kaum untersucht. Das Projekt beschäftigt sich mit der Frage, welche neurobiologischen Mechanismen bei der Konzeption antizipatorischer Assistenzsysteme Berücksichtigung finden müssen. Ziel ist es, die zeitliche Dynamik der neuronalen Aktivität dialog-relevanter Hirnsysteme, sowie psychophysiologische und behaviorale Parameter im Verlauf von interaktiven Aufgabenlösungen zu erfassen. Daraus werden Hypothesen über aktuelle Strategien und Intentionen des Nutzers abgeleitet, die als Grundlage für maßgeschneiderte Interventionen und Metadialogbeiträge durch das technische System dienen. Das Verständnis der Effekte solcher Dialogbeiträge des Systems auf Hirnaktivität und Verhalten wird zur neurowissenschaftlichen Fundierung von Mensch-Technik-Interaktionen beitragen.
Kollaborationspartner:
- Myra Spiliopoulou, Wissensmanagement und Wissensentdeckung, OVGU Magdeburg
Förderung:- EFRE ZS/2017/10/88785 "Hirnmechanismen der Informationsverarbeitung in Dialogen"
Einfluss des Alters auf die Lateralisierung auditorischer Verarbeitung und auf Hemisphäreninteraktion (Stadler, Brechmann, Angenstein)Das Ziel dieses Projektes ist ein besseres Verständnis der Defizite in der zentralen auditorischen Verarbeitung von Personen mit Hörstörungen. Die Verarbeitung von Sprache erfordert die Verarbeitung verschiedener grundlegender akustischer Parameter. An diesen Verarbeitungen sind der linke und rechte Hörkortex unterschiedlich stark beteiligt. Durch diese unterschiedliche Lateralisierung der Verarbeitung ist eine effiziente Zusammenarbeit der Hörkortices beider Hemisphären während auditorischer Verarbeitung erforderlich. Es gibt Hinweise darauf, dass sich die Lateralisierung der Verarbeitung im Gehirn und die Interaktion zwischen den Hemisphären im Alter verändert. Dies kann zu Hördefiziten führen. Wir untersuchen, wie sich im Alter die Beteiligung der Hemisphären und die Hemisphäreninteraktion beim Hören verändert und welchen Effekt dies auf auditorisch-kognitive Fähigkeiten hat. Wir wollen Interventionsansätze entwickeln, um die Hemisphäreninteraktion im Alter auf individueller Ebene zu verbessern, um eine gute Hörkompetenz zu ermöglichen.
Förderung:
- DFG / AN 861/4-2 "Hemispheric interaction during lateralized auditory processing in humans: effects of task difficulty, training and age"
Lateralisierte auditorische Verarbeitung bei Cochlea-Implantat-Trägern (Seidel, Stadler, Deliano, Angenstein)Vielen Personen mit einem starken Hörverlust kann durch Cochlea-Implantate gutes Hören ermöglicht werden. Allerdings gibt es erhebliche Unterschiede in der Sprachwahrnehmung und der Hörqualität nach der Implantation zwischen den Nutzern. Wir untersuchen an Cochlea-Implantat-Trägern die Zusammenhänge zwischen der Implantation, der Lateralisierung auditorischer Verarbeitung und der Hemisphäreninteraktion. Ziel ist es, die Sprachkompetenz von Cochlea-Implantat-Trägern zu verbessern, indem das Wissen über die zentrale Verarbeitung akustischer Grundparameter bei jedem einzelnen Benutzer auf jeder Ebene der klinischen Versorgung berücksichtigt wird. Es sollen die Gründe für die erheblichen Unterschiede in der Sprachwahrnehmung und der Hörqualität nach Implantation von Cochlea-Implantaten aufgezeigt werden. Dies soll eine Anpassung der Behandlung ermöglichen, um bestmögliche Hörqualität und Sprachkompetenz nach der Implantation zu erreichen.
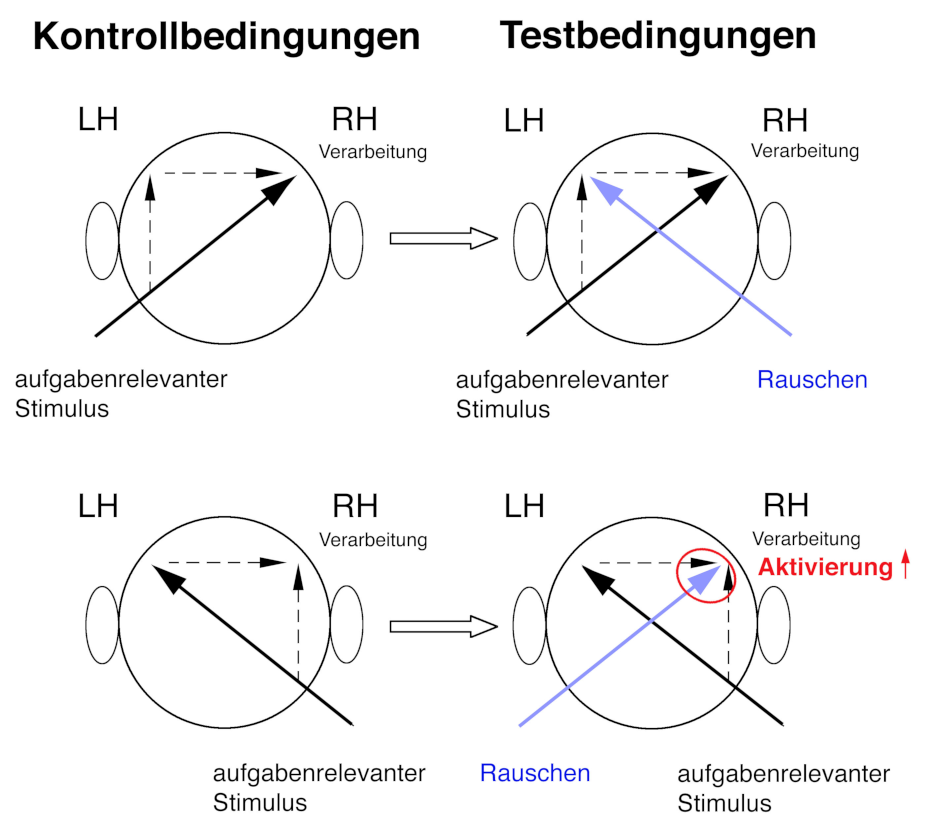
Abbildung: Das kontralaterale Rauschverfahren zur Untersuchung lateralisierter Verarbeitung im menschlichen Hörkortex und Hemisphäreninteraktion mit fMRT
Kollaborationspartner:- Beate Wendt, Klinik für Hals-Nasen-Ohrenheilkunde des Universitätsklinikums der Otto-von-Guericke-Universität Magdeburg; Direktor: Prof. Dr. med. Christoph Arens
- Jesko L. Verhey, Otto-von-Guericke-Universität Magdeburg, Abteilung für Experimentelle Audiologie
- Horst Hessel, Cochlear Deutschland GmbH & Co. KG
Neuronale, behaviorale und psychophysiologische Korrelate von Programmverständnis (Peitek, Brechmann)Software-Entwickler verbringen einen großen Teil ihrer Zeit damit, Quelltext zu lesen und zu verstehen, auch bezeichnet als Programmverständnis. Frühe Theorien von Programmverständnis beschreiben es entweder als einen hypothesen-getriebenen (top-down) oder als einen zeilenbasierten (bottom-up) Mechanismus. Allerdings sind die zugrundeliegenden kognitiven Prozesse von top-down und bottom-up Programmverständnis noch immer unklar. In der ersten Projektphase haben wir diese kognitiven Prozesse mittels objektiven Maßen basierend auf funktioneller Magnetresonanztomografie (fMRT) untersucht. Dabei haben wir Hirnregionen identifiziert, die spezifisch aktiviert sind, wenn Probanden Quelltext verstehen. Das Aktivierungsmuster deutet auf semantische Verarbeitung hin, die an die linke, sprach-dominante Hemisphäre gebunden ist, sowie auf eine Beteiligung von Aufmerksamkeit und Arbeitsgedächtnis. Das gezielte Auslösen von top-down Programmverständnis, z.B. durch Beacons, führte zu einer reduzierten Aktivierung in einigen dieser Hirnareale, was auf einen geringeren kognitiven Aufwand hindeutet. Unsere Ergebnisse haben andere Forscher dazu ermutigt, ebenfalls bildgebende Verfahren zur Untersuchung von Programmverständnis einzusetzen.
In der zweiten Projektphase verfeinern wir unser experimentelles Framework, indem wir einerseits Eye-Tracking integrieren, um den Zeitverlauf der visuellen Aufmerksamkeit für eine spezifischere Analyse der fMRT-Daten zu nutzen, und andererseits psychophysiologische Daten (Pupillenmessung, Hautleitfähigkeit, Pulsfrequenz und Atmung) erheben, um Änderungen der kognitiven Beanspruchung zu bestimmen. Mit diesem Ansatz untersuchen wir den Einfluss von strukturellen Quelltext-Elementen (if-then-else Anweisungen, Schleifen, Rekursion) und Programmiererfahrung auf top-down Programmverständnis. Darüber hinaus beschäftigen wir uns mit der seit Langem diskutierten Frage nach dem Unterschied zwischen objekt-orientierter und funktionaler Programmierung.
Alle Publikationen, Quelltexte und weitere Details zu diesem Projekt sind zu finden unter brains-on-code.github.io.
Kollaborationspartner:
- Janet Siegmund, Technische Universität Chemnitz
- Sven Apel, Universität des Saarlandes
- Chris Parnin, NC State University, Raleigh, North Carolina, USA
Förderung:- DFG BR 2267/2-1 "Verstehen von Programmverständnis im Zeitalter der bildgebenden Verfahren"
- DFG BR 2267/7-2 "Linking Program Comprehension to Neural, Behavioral, and Psycho-Physiological Correlates"
Die Combinatorial NeuroImaging Core Facility
- Team
Fahmida Akter Doktorandin +49-391-6263-95431 Dr. Nicole Angenstein Wissenschaftlerin, PI +49-391-6263-92182 Renate Blobel-Lüer Technische Assistentin Human-Bildgebung +49-391-6263-92172 Dr. André Brechmann CNI-Koordinator, PI +49-391-6263-92161 Prof. Dr. Eike Budinger Verantwortlicher für 9,4T MRT, PI +49-391-6263-95421 Dr. Matthias Deliano Verantwortlicher für Human-EEG, PI +49-391-6263-92151 Dr. Hanna Edler Anwendungsspezialistin CLSM/STED, Lightsheet +49-391-6263-93221 Andreas Fügner Elektrotechniker Human-Bildgebung +49-391-6263-92191 Dr. Jürgen Goldschmidt Verantwortlicher für SPECT/CT, PI +49-391-6263-95421 Lisa-Marie Goncalves Doktorandin +49-391-6263-93471 Tobias Gottschall Forschungsdaten- und Softwareingenieur +49-391-6263-92121 Anna Groppe Doktorandin +49-391-6263-92141 Dr. Hongbo Jia Verantwortlicher für 2-Photonen-Bildgebung +49-391-6263-93331 Dr. Oliver Kobler Verantwortlicher für CLSM/STED, Lightsheet +49-391-6263-93221 Anke Michalsky Technische Assistentin 3T MRT +49-391-6263-92191 Dr. Norman Peitek Gastwissenschaftler +49-391-6263-92152 Holger Reim Technischer Assistent SPECT/CT +49-391-6263-95431 Gabriele Schöps Technische Assistentin EEG +49-391-6263-91351 Dr. Jörg Stadler Verwantwortlicher für Human-MRT +49-391-6263-92171 Janet Stallmann Technische Assistentin 9,4T MRT +49-391-6263-95461 Patricia Wenk Anwendungspezialistin 9,4T MRT +49-391-6263-95431 - Publikationen
Publikationen
2024
Angenstein N. 2024. Asymmetries and hemispheric interaction in the auditory system of elderly people. Frontiers in Neuroimaging. 2:Article 1320989. https://doi.org/10.3389/fnimg.2023.1320989
Murkar R., von Heckel C., Walles H., Moch T.B., Arens C., Davaris N., Weber A., Zuschratter W., Baumann S., Reinhardt J., Kopp S. 2024. Establishment of a Human Immunocompetent 3D Tissue Model to Enable the Long-Term Examination of Biofilm–Tissue Interactions. Bioengineering. 11 (2), art. no. 187. https://doi.org/10.3390/bioengineering11020187
Muehlberg F, Mohnike K, Grosser OS, Pech M, Goldschmidt J, Smalla K-H, Seidensticker R, Ümütlü MR, Deniz S, Ricke J, et al. 2024. In vivo evaluation of tumor uptake and bio-distribution of 99mTc-labeled 1-thio-β-D-glucose and 5-thio-D-glucose in mice model. EJNMMI radiopharmacy and chemistry. 9(1):Article 26. https://doi.org/10.1186/s41181-024-00253-3
Oelschlegel AM, Bhattacharjee R, Wenk P, Harit K, Rothkötter H-J, Koch SP, Boehm-Sturm P, Matuschewski K, Budinger E, Schlüter D, et al. 2024. Beyond the microcirculation: sequestration of infected red blood cells and reduced flow in large draining veins in experimental cerebral malaria. Nature Communications. 15(1):Article 2396. https://doi.org/10.1038/s41467-024-46617-w
2023
Adasme T, Hidalgo C, Herrera-Molina R. 2023. Editorial: Emerging views and players in neuronal calcium signaling: synaptic plasticity, learning/memory, aging and neuroinflammation. Frontiers in Cellular Neuroscience. 17:Article 1197417. https://doi.org/10.3389/fncel.2023.1197417
Angenstein N, Brancucci A. 2023. Editorial: Hemispheric asymmetries in the auditory domain, volume II. Frontiers in Neuroscience. 17:Article 1263317. https://doi.org/10.3389/fnins.2023.1263317
Bellmann P, Kessler V, Brechmann A, Schwenker F. 2023. Button Press Dynamics: Beyond Binary Information in Button Press Decisions. Lecture Notes in Networks and Systems: 469-477. https://doi.org/10.1007/978-981-19-0105-8_46
Grandjean J, Desrosiers-Gregoire G, Anckaerts C, Angeles-Valdez D, Ayad F, Barrière DA, Blockx I, Bortel A, Broadwater M, Cardoso BM, et al. 2023. A consensus protocol for functional connectivity analysis in the rat brain. Nature Neuroscience. 26(4):673-681. https://doi.org/10.1038/s41593-023-01286-8
Grochowska KM, Gomes GM, Raman R, Kaushik R, Sosulina L, Kaneko H, Oelschlegel AM, Yuanxiang P, Reyes-Resina I, Bayraktar G, … Goldschmidt J. …et al. 2023. Jacob-induced transcriptional inactivation of CREB promotes Aβ-induced synapse loss in Alzheimer's disease. The EMBO journal. 42(4):Article e112453. https://doi.org/10.15252/embj.2022112453
Gu M, Li X, Liang S, Zhu J, Sun P, He Y, Yu H, Li R, Zhou Z, Lyu J, … Jia H. … et al. 2023. Rabies virus-based labeling of layer 6 corticothalamic neurons for two-photon imaging in vivo. iScience. 26(5):Article 106625. https://doi.org/10.1016/j.isci.2023.106625
Huang J, Liang S, Li L, Li X, Liao X, Hu Q, Zhang C, Jia H, Chen X, Wang M, et al. 2023. Daily two-photon neuronal population imaging with targeted single-cell electrophysiology and subcellular imaging in auditory cortex of behaving mice. Frontiers in Cellular Neuroscience. 17:Article 1142267. https://doi.org/10.3389/fncel.2023.1142267
Huang W, Wang Y, Qin J, He C, Li Y, Wang Y, Li M, Lyu J, Zhou Z, Jia H, et al. 2023. A corticostriatal projection for sound-evoked and anticipatory motor behavior following temporal expectation. NeuroReport. 34(1):1-8. https://doi.org/10.1097/WNR.0000000000001851
Jamaludeen N, Kuhn F, Brechmann A, Fuhrmann F, Remy S, Spiliopoulou M. 2023. Inferring Salient Motifs during Learning Experiments. Sicilia R, Kane B, Almeida JR, Spiliopoulou M, Andrades JAB, Placidi G, Gonzalez AR, Hrsg. in Proceedings - 2023 IEEE 36th International Symposium on Computer-Based Medical Systems, CBMS 2023. IEEE. S. 245-251. (Proceedings - IEEE Symposium on Computer-Based Medical Systems). https://doi.org/10.1109/CBMS58004.2023.00225
Li R, Huang J, Li L, Zhao Z, Liang S, Liang S, Wang M, Liao X, Lyu J, Zhou Z, et al. 2023. Holistic bursting cells store long-term memory in auditory cortex. Nature Communications. 14(1):Article 8090. https://doi.org/10.1038/s41467-023-43620-5
Li X, Song S, Yao J, Liao X, Chen M, Zhai J, Lang L, Lin C, Zhang N, Yuan C, … Jia H … et al. 2023. Autofluorescence spectral analysis for detecting urinary stone composition in emulated intraoperative ambient. Spectrochimica acta. Part A, Molecular and biomolecular spectroscopy. 300:Article 122913. https://doi.org/10.1016/j.saa.2023.122913
Li R, Wang S, Lyu J, Chen K, Sun X, Huang J, Sun P, Liang S, Li M, Yang M, … Jia H … et al. 2023. Ten-kilohertz two-photon microscopy imaging of single-cell dendritic activity and hemodynamics in vivo. Neurophotonics. 10(2):Article 025006. https://doi.org/10.1117/1.NPh.10.2.025006
Malci A, Lin X, Shi YS, Herrera-Molina R. 2023. Neuroplastin in Ca2+ signal regulation and plasticity of glutamatergic synapses. Neural Regeneration Research. 18(8):1705-1706. https://doi.org/10.4103/1673-5374.363826
Mancini N, Thoener J, Tafani E, Pauls D, Mayseless O, Strauch M, Eichler K, Champion A, Kobler O, Weber D, et al. 2023. Rewarding capacity of optogenetically activating a giant GABAergic central-brain interneuron in larval Drosophila. Journal of Neuroscience. 43(44):7393-7428. https://doi.org/10.1523/JNEUROSCI.2310-22.2023
Montag D, Liang Y, Herrera-Molina R, Lin X, Ormazabal-Toledo R, Yao S, Shi YS. 2023. Deafness causing neuroplastin missense variants fail to promote plasma membrane Ca2+-ATPase levels and Ca2+ transient regulation in brain neurons. Journal of Biological Chemistry.
Nöthen T, Sarabi MA, Weinert S, Zuschratter W, Morgenroth R, Mertens PR, Braun-Dullaeus RC, Medunjanin S. 2023. DNA-Dependent Protein Kinase Mediates YB-1 (Y-Box Binding Protein)-Induced Double Strand Break Repair. Arteriosclerosis, thrombosis, and vascular biology. 43(2):300-311. https://doi.org/10.1161/ATVBAHA.122.317922
Sen ZD, Chand T, Danyeli LV, Kumar VJ, Colic L, Li M, Yemisken M, Javaheripour N, Refisch A, Opel N, et al. 2023. The effect of ketamine on affective modulation of the startle reflex and its resting-state brain correlates. Scientific Reports. 13(1):Article 13323. https://doi.org/10.1038/s41598-023-40099-4
Stadler J, Brechmann A, Angenstein N. 2023. Effect of age on lateralized auditory processing. Hearing Research. 434:Article 108791. https://doi.org/10.1016/j.heares.2023.108791
Stollmeier M, Kahlert S, Zuschratter W, Oster M, Wimmers K, Isermann B, Rothkötter H-J, Nossol C. 2023. Air-liquid interface cultures trigger a metabolic shift in intestinal epithelial cells (IPEC-1). Histochemistry and cell biology. https://doi.org/10.1007/s00418-023-02180-x
Stöter T, Gottschall T, Schrader A, Zentis P, Valencia-Schneider M, Kandpal N, Zuschratter W, Schauss A, Dickscheid T, Mühlhaus T, et al. 2023. Combining the BIDS and ARC Directory Structures for Multimodal Research Data Organization. https://doi.org/10.5281/zenodo.8349563
Thane M, Paisios E, Stöter T, Krüger A-R, Gläß S, Dahse A-K, Scholz N, Gerber B, Lehmann DJ, Schleyer M. 2023. High-resolution analysis of individual Drosophila melanogaster larvae uncovers individual variability in locomotion and its neurogenetic modulation. Open biology. 13(4):Article 220308. https://doi.org/10.1098/rsob.220308
Vosskuhl J, Herrmann CS, Brechmann A, Scheich H. 2023 Simultaneous Electroencephalography and Functional Magnetic Resonance Imaging of the Human Auditory System. In EEG-fMRI: Physiological Basis, Technique, and Applications, Second Edition, pp. 547-564. https://doi.org/10.1007/978-3-031-07121-8_22
Wolff S, Brechmann A. 2023. Dorsal posterior cingulate cortex responds to negative feedback information supporting learning and relearning of response policies. Cerebral Cortex. 33(10):5947-5956. https://doi.org/10.1093/cercor/bhac473
2022
Chander BS, Deliano M, Azañón E, Büntjen L, Stenner M-P. 2022. Non-invasive recording of high-frequency signals from the human spinal cord. NeuroImage. 253:Article 119050. https://doi.org/10.1016/j.neuroimage.2022.119050
Deliano M, Seidel P, Vorwerk U, Stadler B, Angenstein N. 2022. Effect of cochlear implant side on early speech processing in adults with single-sided deafness. Clinical Neurophysiology. 140:29-39. https://doi.org/10.1016/j.clinph.2022.05.008
Ding F, Liang S, Li R, Yang Z, He Y, Yang S, Duan Q, Zhang J, Lyu J, Zhou Z, et al. 2022. Astrocytes exhibit diverse Ca2+ changes at subcellular domains during brain aging. Frontiers in Aging Neuroscience. 14:Article 1029533. https://doi.org/10.3389/fnagi.2022.1029533
Guzmán Salas S, Weber A, Malci A, Lin X, Herrera-Molina R, Cerpa W, Dorador C, Signorelli J, Zamorano P. 2022. The metabolite p-cresol impairs dendritic development, synaptogenesis and synapse function in hippocampal neurons: Implications for autism spectrum disorder. Journal of Neurochemistry. https://doi.org/10.1111/jnc.15604
Jamaludeen N, Unnikrishnan V, Brechmann A, Spiliopoulou M. 2022. Discovering Instantaneous Granger Causalities in Non-stationary Categorical Time Series Data. Michalowski M, Abidi SSR, Abidi S, Hrsg. in Artificial Intelligence in Medicine - 20th International Conference on Artificial Intelligence in Medicine, AIME 2022, Proceedings. Springer Lecture Notes in Computer Science: 200-209. https://doi.org/10.1007/978-3-031-09342-5_19
Malci A, Sandoval R, Gundelfinger ED, Naumann M, Seidenbecher C, Herrera-Molina R. 2022. Ca2+ signaling in postsynaptic neurons: neuroplastin-65 regulates the interplay between plasma membrane Ca2+ ATPases and ionotropic glutamate receptors. Cell calcium. 106:Article 102623. https://doi.org/10.1016/j.ceca.2022.102623
Meka DP, Kobler O, Hong S, Friedrich CM, Wuesthoff S, Henis M, Schwanke B, Krisp C, Schmuelling N, Rueter R, Ruecker T, Betleja E, Cheng T, Mahjoub MR, Soba P, Schlüter H, Fornasiero EF, Calderon de Anda F. 2022. Centrosome-dependent microtubule modifications set the conditions for axon formation. Cell Reports. 39(3):Article 110686. https://doi.org/10.1016/j.celrep.2022.110686
Oleksiievets N, Mathew C, Thiele JC, Gallea JI, Nevskyi O, Gregor I, Weber A, Tsukanov R, Enderlein J. 2022. Single-Molecule Fluorescence Lifetime Imaging Using Wide-Field and Confocal-Laser Scanning Microscopy: A Comparative Analysis. Nano letters. https://doi.org/10.1021/acs.nanolett.2c01586
Qin H, Fu L, Jian T, Jin W, Liang M, Li J, Chen Q, Yang X, Du H, Liao X, et al. 2022. REM sleep-active hypothalamic neurons may contribute to hippocampal social-memory consolidation. Neuron. 110(23):4000-4014.e6. https://doi.org/10.1016/j.neuron.2022.09.004
Saldeitis K, Jeschke M, Michalek A, Henschke JU, Wetzel W, Ohl FW, Budinger E. 2022. Selective interruption of auditory interhemispheric crosstalk impairs discrimination learning of frequency-modulated tone direction but not gap detection and discrimination. Journal of Neuroscience. 42(10):2025-2038. https://doi.org/10.1523/JNEUROSCI.0216-21.2022
Tang J, Xue R, Wang Y, Li M, Jia H, Pakan JMP, Li L, Chen X, Li X. 2022. Optical Fiber-Based Recording of Climbing Fiber Ca2+ Signals in Freely Behaving Mice. Biology. 11(6):Article 907. https://doi.org/10.3390/biology11060907
Tegelbeckers J, Brechmann A, Breitling-Ziegler C, Bonath B, Flechtner H-H, Krauel K. 2022. Neural Mechanisms Underlying the Effects of Novel Sounds on Task Performance in Children With and Without ADHD. Frontiers in Human Neuroscience. 16:Article 878994. https://doi.org/10.3389/ fnhum.2022.878994
Wackernagel L-M, Abdi Sarabi M, Weinert S, Zuschratter W, Richter K, Fischer KD, Braun-Dullaeus RC, Medunjanin S. 2022. IKKγ/NEMO Localization into Multivesicular Bodies. International Journal of Molecular Sciences. 23(12):Article 6778. https://doi.org/10.3390/ijms23126778
Wang M, Liu K, Pan J, Li J, Sun P, Zhang Y, Li L, Guo W, Xin Q, Zhao Z, Liu Y, Zhou Z, Lyu J, Zheng T, Han Y, Zhang C, Liao X, Zeng S, Jia H, Chen X. 2022. Brain-wide projection reconstruction of single functionally defined neurons. Nature Communications. 13(1):Article 1531. https://doi.org/10.1038/s41467-022-29229-0
2021
Braun K, Mannewitz A, Bock J, Kreitz S, Hess A, Scheich H, Goldschmidt J. 2021. Imaging of Functional Brain Circuits during Acquisition and Memory Retrieval in an Aversive Feedback Learning Task: Single Photon Emission Computed Tomography of Regional Cerebral Blood Flow in Freely Behaving Rats. Brain Sciences. 11(5):Article 659. https://doi.org/10.3390/brainsci11050659
Buentjen L, Vicheva P, Chander BS, Beccard S-A, Coutts C, Azañón E, Stenner M-P, Deliano M. 2021. Spatial Filtering of Electroencephalography Reduces Artifacts and Enhances Signals Related to Spinal Cord Stimulation (SCS). Neuromodulation : journal of the International Neuromodulation Society. 24(8):1317-1326. https://doi.org/10.1111/ner.13266
Debska-Vielhaber G, Miller I, Peeva V, Zuschratter W, Walczak J, Schreiber S, Petri S, Machts J, Vogt S, Szczepanowska J, Gellerich FN, Hermann A, Vielhaber S, Kunz WS. 2021. Impairment of mitochondrial oxidative phosphorylation in skin fibroblasts of SALS and FALS patients is rescued by in vitro treatment with ROS scavengers. Experimental Neurology. 339:Article 113620. https://doi.org/10.1016/j.expneurol.2021.113620
Düsedau HP, Steffen J, Figueiredo CA, Boehme JD, Schultz K, Erck C, Korte M, Faber-Zuschratter H, Smalla K-H, Dieterich D, Kröger A, Bruder D, Dunay IR. 2021. Influenza A Virus (H1N1) Infection Induces Microglial Activation and Temporal Dysbalance in Glutamatergic Synaptic Transmission. mBio. 12(5):Article e0177621. https://doi.org/10.1128/mBio.01776-21
El-Tabbal M, Niekisch H, Henschke JU, Budinger E, Frischknecht R, Deliano M, Happel MFK. 2021. The extracellular matrix regulates cortical layer dynamics and cross-columnar frequency integration in the auditory cortex. Communications biology. 4(1):Article 322. https://doi.org/10.1038/s42003-021-01837-4
Hajizadeh A, Matysiak A, Brechmann A, König R, May PJC. 2021. Why do humans have unique auditory event-related fields? Evidence from computational modeling and MEG experiments. Psychophysiology. 58(4):Article e13769. https://doi.org/10.1111/psyp.13769
Ilic K, Lin X, Malci A, Stojanović M, Puljko B, Rožman M, Vukelić Ž, Heffer M, Montag D, Schnaar RL, Kalanj-Bognar S, Herrera-Molina R, Mlinac-Jerkovic K. 2021. Plasma membrane calcium ATPase-neuroplastin complexes are selectively stabilized in GM1-containing lipid rafts. International Journal of Molecular Sciences. 22(24):Article 13590. https://doi.org/10.3390/ijms222413590
Kobler O, Weiglein A, Hartung K, Chen Y-C, Gerber B, Thomas U. 2021. A quick and versatile protocol for the 3D visualization of transgene expression across the whole body of larval Drosophila. Journal of Neurogenetics. 35(3):306-319. https://doi.org/10.1080/01677063.2021.1892096
Krick N, Ryglewski S, Pichler A, Bikbaev A, Götz T, Kobler O, Heine M, Thomas U, Duch C. 2021. Separation of presynaptic Cav2 and Cav1 channel function in synaptic vesicle exo- and endocytosis by the membrane anchored Ca2+ pump PMCA. Proceedings of the National Academy of Sciences of the United States of America. 118(28):Article e2106621118. https://doi.org/10.1073/pnas.2106621118
Lin X, Brunk MGK, Yuanxiang P, Curran AW, Zhang E, Stöber F, Goldschmidt J, Gundelfinger ED, Vollmer M, Happel MFK, Herrera-Molina R, Montag D. 2021. Neuroplastin expression is essential for hearing and hair cell PMCA expression. Brain Structure and Function. 226(5):1533-1551. https://doi.org/10.1007/s00429-021-02269-w
Lin X, Liang Y, Herrera-Molina R, Montag D. 2021. Neuroplastin in Neuropsychiatric Diseases. Genes. 12(10):Article 1507. https://doi.org/10.3390/genes12101507
Peitek N, Apel S, Parnin C, Brechmann A, Siegmund J. 2021. Program Comprehension and Code Complexity Metrics: An fMRI Study. In International Conference on Software Engineering (ICSE). IEEE Computer Society. pp. 524-536. https://doi.org/10.1109/ICSE43902.2021.00056
Prior MJW, Bast T, McGarrity S, Goldschmidt J, Vincenz D, Seaton A, Hall G, Pitiot A. 2021. Ratlas-LH: An MRI template of the Lister hooded rat brain with stereotaxic coordinates for neurosurgical implantations. Brain and neuroscience advances. 5:Article 23982128211036332. https://doi.org/10.1177/23982128211036332
Saldeitis K, Jeschke M, Budinger E, Ohl FW, Happel MFK. 2021. Laser-Induced Apoptosis of Corticothalamic Neurons in Layer VI of Auditory Cortex Impact on Cortical Frequency Processing. Frontiers in neural circuits. 15:Article 659280. https://doi.org/10.3389/fncir.2021.659280
Wang M, Weber A, Hartig R, Zheng Y, Krafft D, Vidaković-Koch T, Zuschratter W, Ivanov I, Sundmacher K. 2021. Scale up of Transmembrane NADH Oxidation in Synthetic Giant Vesicles. Bioconjugate chemistry. 32(5):897-903. https://doi.org/10.1021/acs.bioconjchem.1c00096
Wendt B, Stadler J, Verhey JL, Hessel H, Angenstein N. 2021. Effect of contralateral noise on speech intelligibility. Neuroscience. 459:59-69. https://doi.org/10.1016/j.neuroscience.2021.01.034
2020
Abolfazli A, Brechmann A, Wolff S, Spiliopoulou M. 2020. Machine learning identifies the dynamics and influencing factors in an auditory category learning experiment. Scientific Reports. 10(1):Article 6548. https://doi.org/10.1038/s41598-020-61703-x
Aggelopoulos NC, Deike S, Selezneva E, Scheich H, Brechmann A, Brosch M. 2020. Predictive cues for auditory stream formation in humans and monkeys. European Journal of Neuroscience. 51(5):1254-1264. https://doi.org/10.1111/ejn.13808
Buentjen L, Vicheva P, Chander BS, Beccard S-A, Coutts C, Azañón E, Stenner M-P, Deliano M. 2020. Spatial Filtering of Electroencephalography Reduces Artifacts and Enhances Signals Related to Spinal Cord Stimulation (SCS). Neuromodulation: Journal of the International Neuromodulation Society. https://doi.org/10.1111/ner.13266
Deane KE, Brunk MGK, Curran AW, Zempeltzi MM, Ma J, Lin X, Abela F, Aksit S, Deliano M, Ohl FW, Happel MFK. 2020. Ketamine anaesthesia induces gain enhancement via recurrent excitation in granular input layers of the auditory cortex. Journal of Physiology. https://doi.org/10.1113/JP279705
Deliano M, Brunk MGK, El-Tabbal M, Zempeltzi MM, Happel MFK, Ohl FW. 2020. Dopaminergic neuromodulation of high gamma stimulus phase-locking in gerbil primary auditory cortex mediated by D1/D5-receptors. European Journal of Neuroscience. 51(5):1315-1327. https://doi.org/10.1111/ejn.13898
Dürschmid S, Reichert C, Walter N, Hinrichs H, Heinze H-J, Ohl FW, Tononi G, Deliano M. 2020. Self-regulated critical brain dynamics originate from high frequency-band activity in the MEG. PloS one. 15 (6):e0233589. https://doi.org/10.1371/journal.pone.0233589
Goldschmidt J, Oelschlegel A. 2020. Functional Neuroimaging in Rodents Using Cerebral Blood Flow SPECT. Frontiers in Physics. 8:Article 152. https://doi.org/10.3389/fphy.2020.00152
Hanke M, Mathôt S, Ort E, Peitek N, Stadler J, Wagner A. 2020. A Practical Guide to Functional Magnetic Resonance Imaging with Simultaneous Eye Tracking for Cognitive Neuroimaging Research. Pollmann S, editor. In Neuromethods: Spatial Learning and Attention Guidance. Humana Press. pp. 291-305. (Neuromethods). https://doi.org/10.1007/7657_2019_31
Heimrath K, Brechmann A, Blobel-Lüer R, Stadler J, Budinger E, Zaehle, T. 2020. Transcranial direct current stimulation (tDCS) over the auditorymcortex modulates GABA and glutamate: a 7 T MR-spectroscopy study.
Scientific Reports, 10 (1), art. no. 20111. https://doi.org/10.1038/s41598-020-77111-0Lommerzheim M, Prezenski S, Russwinkel N, Brechmann A. 2020. Category learning as a use case for anticipating individual human decision making by intelligent systems. Advances in Intelligent Systems and Computing, 1131 AISC, pp. 159-164. https://doi.org/10.1007/978-3-030-39512-4_25
Oleksiievets N, Thiele JC, Weber A, Gregor I, Nevskyi O, Isbaner S, Tsukanov R, Enderlein J. 2020. Wide-Field Fluorescence Lifetime Imaging of Single Molecules. Journal of Physical Chemistry A. 124(17):3494-3500. https://doi.org/10.1021/acs.jpca.0c01513
Medunjanin S, Putzier M, Nöthen T, Weinert S, Kähne T, Luani B, Zuschratter W, Braun-Dullaeus RC. 2020. DNA-PK: gatekeeper for IKKγ/NEMO nucleocytoplasmic shuttling in genotoxic stress-induced NF-kappaB activation. Cellular and Molecular Life Sciences. https://doi.org/10.1007/s00018-019-03411-y
Park JY, Polzehl J, Chatterjee S, Brechmann A, Fiecas M. 2020. Semiparametric modeling of time-varying activation and connectivity in task-based fMRI data. Computational Statistics and Data Analysis, 150, art. no. 107006 https://doi.org/10.1016/j.csda.2020.107006
Peitek N, Siegmund J, Apel S, Kastner C, Parnin C, Bethmann A, Leich T, Saake G, Brechmann A. 2020. A Look into Programmers Heads. IEEE Transactions on Software Engineering. 46(4):442-462. https://doi.org/10.1109/TSE.2018.2863303
Siegmund J, Peitek N, Brechmann A, Parnin C, Apel S. 2020. Studying Programming in the Neuroage: Just a Crazy Idea?. Communications of the ACM. 63(6):30-34. https://doi.org/10.1145/3347093
Sikka A, Jamalabadi H, Krylova M, Alizadeh S, van der Meer JN, Danyeli L, Deliano M, Vicheva P, Hahn T, Koenig T, Bathula DR, Walter M. 2020. Investigating the temporal dynamics of electroencephalogram (EEG) microstates using recurrent neural networks. Human Brain Mapping. 41(9):2334-2346. https://doi.org/10.1002/hbm.24949
Vemula SK, Malci A, Junge L, Lehmann AC, Rama R, Hradsky J, Matute RA, Weber A, Prigge M, Naumann M, Kreutz MR, Seidenbecher CI, Gundelfinger ED, Herrera-Molina R. 2020. The Interaction of TRAF6 With Neuroplastin Promotes Spinogenesis During Early Neuronal Development. Frontiers in Cell and Developmental Biology. 8:Article 579513. https://doi.org/10.3389/fcell.2020.579513
Weber A, Zuschratter W, Hauser MJB. 2020. Partial synchronisation of glycolytic oscillations in yeast cell populations. Scientific Reports. 10(1):Article 19714. https://doi.org/10.1038/s41598-020-76242-8
Weidner TC, Vincenz D, Brocka M, Tegtmeier J, Oelschlegel AM, Ohl FW, Goldschmidt J, Lippert MT. 2020. Matching stimulation paradigms resolve apparent differences between optogenetic and electrical VTA stimulation. Brain Stimulation. 13(2):363-371. https://doi.org/10.1016/j.brs.2019.11.005
Wolff S, Kohrs C, Angenstein N, Brechmann A. 2020. Dorsal posterior cingulate cortex encodes the informational value of feedback in human-computer interaction. Scientific Reports. 10(1):Article 13030. https://doi.org/10.1038/s41598-020-68300-y
Zempeltzi MM, Kisse M, Brunk MGK, Glemser C, Aksit S, Deane KE, Maurya S, Schneider L, Ohl FW, Deliano M, Happel MFK. 2020. Task rule and choice are reflected by layer-specific processing in rodent auditory cortical microcircuits. Communications biology. 3(1):Article 345. https://doi.org/10.1038/s42003-020-1073-3
2019
Angenstein F. 2019. The role of ongoing neuronal activity for baseline and stimulus-induced BOLD signals in the rat hippocampus. NeuroImage. 202:Article 116082. https://doi.org/10.1016/j.neuroimage.2019.116082
Bauer J, Siegmund J, Peitek N, Hofmeister J, Apel S. 2019. Indentation: Simply a Matter of Style or Support for Program Comprehension?. In Proceedings - 2019 IEEE/ACM 27th International Conference on Program Comprehension, ICPC 2019. IEEE. pp. 154-164. (IEEE International Conference on Program Comprehension). https://doi.org/10.1109/ICPC.2019.00033
Bovet-Carmona M, Krautwald K, Menigoz A, Vennekens R, Balschun D, Angenstein F. 2019. Low frequency pulse stimulation of Schaffer collaterals in Trpm4−/− knockout rats differently affects baseline BOLD signals in target regions of the right hippocampus but not BOLD responses at the site of stimulation. NeuroImage. 188:347-356. https://doi.org/10.1016/j.neuroimage.2018.12.020
Brechmann A, Angenstein N. 2019. The impact of task difficulty on the lateralization of processing in the human auditory cortex. Human Brain Mapping. 40(18):5341-5353. https://doi.org/10.1002/hbm.24776
Brunk MGK, Deane KE, Kisse M, Deliano M, Vieweg S, Ohl FW, Lippert MT, Happel MFK. 2019. Optogenetic stimulation of the VTA modulates a frequency-specific gain of thalamocortical inputs in infragranular layers of the auditory cortex. Scientific Reports. 9(1):Article 20385. https://doi.org/10.1038/s41598-019-56926-6
Döring M, Blees H, Koller N, Tischer-Zimmermann S, Müsken M, Henrich F, Becker J, Grabski E, Wang J, Janssen H, Zuschratter W, Neefjes J, Klawonn F, Eiz-Vesper B, Tampé R, Kalinke U. 2019. Modulation of TAP-dependent antigen compartmentalization during human monocyte-to-DC differentiation. Blood advances. 3(6):839-850. https://doi.org/10.1182/bloodadvances.2018027268
Leschik J, Eckenstaler R, Endres T, Munsch T, Edelmann E, Richter K, Kobler O, Fischer K-D, Zuschratter W, Brigadski T, Lutz B, Lessmann V. 2019. Prominent Postsynaptic and Dendritic Exocytosis of Endogenous BDNF Vesicles in BDNF-GFP Knock-in Mice. Molecular Neurobiology. 56(10):6833-6855. https://doi.org/10.1007/s12035-019-1551-0
Macharadze T, Budinger E, Brosch M, Scheich H, Ohl FW, Henschke JU. 2019. Early Sensory Loss Alters the Dendritic Branching and Spine Density of Supragranular Pyramidal Neurons in Rodent Primary Sensory Cortices. Frontiers in neural circuits. 13:Article 61. https://doi.org/10.3389/fncir.2019.00061
Mattern H, Sciarra A, Lüsebrink F, Acosta-Cabronero J, Speck O. 2019. Prospective motion correction improves high-resolution quantitative susceptibility mapping at 7T. Magnetic Resonance in Medicine. 81(3):1605-1619. https://doi.org/10.1002/mrm.27509
Meka DP, Scharrenberg R, Zhao B, Kobler O, König T, Schaefer I, Schwanke B, Klykov S, Richter M, Eggert D, Windhorst S, Dotti CG, Kreutz MR, Mikhaylova M, Calderon de Anda F. 2019. Radial somatic F-actin organization affects growth cone dynamics during early neuronal development. EMBO Reports. 20(12):Article e47743. https://doi.org/10.15252/embr.201947743
Peitek N, Apel S, Brechmann A, Parnin C, Siegmund J. 2019. CodersMUSE: Multi-Modal Data Exploration of Program-Comprehension Experiments. In Proceedings - 2019 IEEE/ACM 27th International Conference on Program Comprehension, ICPC 2019. IEEE. pp. 126-129. https://doi.org/10.1109/ICPC.2019.00027
Saldeitis K, Richter K, Fischer K-D, Ohl FW, Mateos JM, Budinger E. 2019. Ultrastructure of giant thalamic terminals in the auditory cortex. European Journal of Neuroscience. 50(9):3445-3453. https://doi.org/10.1111/ejn.14509
Schicknick H, Henschke JU, Budinger E, Ohl FW, Gundelfinger ED, Tischmeyer W. 2019. β-adrenergic modulation of discrimination learning and memory in the auditory cortex. European Journal of Neuroscience. 50(7):3141-3163. https://doi.org/10.1111/ejn.14480
van Bommel B, Konietzny A, Kobler O, Bär J, Mikhaylova M. 2019. F-actin patches associated with glutamatergic synapses control positioning of dendritic lysosomes. EMBO Journal. 38(15):e101183. https://doi.org/10.15252/embj.2018101183
Wagner M, Mahlmann A, Deindl E, Zuschratter W, Riek-Burchardt M, Kostin S, Luani B, Baer C, Youssef A, Herold J. 2019. Clinical improvement and enhanced collateral vessel growth after xenogenic monocyte transplantation. American journal of translational research. 11(7):4063-4076.
Wendemuth A, Boeck R, Nuernberger A, Al-Hamadi A, Brechmann A, Ohl FW. 2019. Intention-Based Anticipatory Interactive Systems. In Proceedings - 2018 IEEE International Conference on Systems, Man, and Cybernetics, SMC 2018. Institute of Electrical and Electronics Engineers Inc. pp. 2583-2588. (IEEE International Conference on Systems, Man, and Cybernetics). https://doi.org/10.1109/SMC.2018.00442
Zempeltzi M-M, Kisse M, Brunk MGK, Glemser C, Aksit S, Deane KE, Maurya S, Schneider L, Ohl F, Deliano M, Happel M. 2019. Task rule and choice are reflected by layer-specific processing in rodent auditory cortical microcircuits. bioRxiv. https://doi.org/10.1101/860064
2018
Acosta-Cabronero J, Milovic C, Mattern H, Tejos C, Speck O, Callaghan MF. 2018. A robust multi-scale approach to quantitative susceptibility mapping. NeuroImage. 183:7-24. https://doi.org/10.1016/j.neuroimage.2018.07.065
Annamneedi A, Caliskan G, Müller S, Montag D, Budinger E, Angenstein F, Fejtova A, Tischmeyer W, Gundelfinger ED, Stork O. 2018. Ablation of the presynaptic organizer Bassoon in excitatory neurons retards dentate gyrus maturation and enhances learning performance. Brain Structure and Function. 223(7):3423-3445. https://doi.org/10.1007/s00429-018-1692-3
Bovet-Carmona M, Menigoz A, Pinto S, Tambuyzer T, Krautwald K, Voets T, Aerts JM, Angenstein F, Vennekens R, Balschun D. 2018. Disentangling the role of TRPM4 in hippocampus-dependent plasticity and learning: an electrophysiological, behavioral and FMRI approach. Brain Structure and Function. 223(8):3557-3576. https://doi.org/10.1007/s00429-018-1706-1
Brocka M, Helbing C, Vincenz D, Scherf T, Montag D, Goldschmidt J, Angenstein F, Lippert M. 2018. Contributions of dopaminergic and non-dopaminergic neurons to VTA-stimulation induced neurovascular responses in brain reward circuits. NeuroImage. 177:88-97. https://doi.org/10.1016/j.neuroimage.2018.04.059
Budinger E, Kanold P. 2018. Auditory cortical circuits. Oliver DL, Cant N, Fay RR, Popper AN, editors. In The Mammalian Auditory Pathways: Synaptic Organization and Microcircuits. New York: Springer. pp. 199 - 233. (Springer Handbook of Auditory Research). https://doi.org/10.1007/978-3-319-71798-2_8
Bulitta B, Zuschratter W, Bernal I, Bruder D, Klawonn F, von Bergen M, Garritsen HSP, Jänsch L. 2018. Proteomic definition of human mucosal-associated invariant T cells determines their unique molecular effector phenotype. European Journal of Immunology. 48(8):1336-1349. https://doi.org/10.1002/eji.201747398
Deliano M, Brunk MGK, El-Tabbal M, Zempeltzi MM, Happel MFK, Ohl FW. 2018. Dopaminergic neuromodulation of high gamma stimulus phase-locking in gerbil primary auditory cortex mediated by D1/D5-receptors. European Journal of Neuroscience. https://doi.org/10.1111/ejn.13898
Edelmann B, Gupta N, Schnoeder TM, Oelschlegel AM, Shahzad K, Goldschmidt J, Philipsen L, Weinert S, Ghosh A, Saalfeld FC, Nimmagadda SC, Müller P, Braun-Dullaeus R, Mohr J, Wolleschak D, Kliche S, Amthauer H, Heidel FH, Schraven B, Isermann B, Müller AJ, Fischer T. 2018. JAK2-V617F promotes venous thrombosis through β1/β2 integrin activation. Journal of Clinical Investigation. 128(10):4359-4371. https://doi.org/10.1172/JCI90312
Friebe B, Richter M, Penzlin S, Stärke C, Kropf S, Lohmann C, Fischbach F, Speck O. 2018. Assessment of Low-Grade Meniscal and Cartilage Damage of the Knee at 7 T: A Comparison to 3 T Imaging with Arthroscopic Correlation. Investigative Radiology. 53(7):390-396. https://doi.org/10.1097/RLI.0000000000000456
Henschke JU, Oelschlegel AM, Angenstein F, Ohl FW, Goldschmidt J, Kanold PO, Budinger E. 2018. Early sensory experience influences the development of multisensory thalamocortical and intracortical connections of primary sensory cortices. Brain Structure and Function. 223(3):1165-1190. https://doi.org/10.1007/s00429-017-1549-1
Henschke JU, Ohl FW, Budinger E. 2018. Crossmodal connections of primary sensory cortices largely vanish during normal aging. Frontiers in Aging Neuroscience. 10(MAR). https://doi.org/10.3389/fnagi.2018.00052
Herrmann T, Liebig T, Mallow J, Bruns C, Stadler J, Mylius J, Brosch M, Svedja JT, Chen Z, Rennings A, Scheich H, Plaumann M, Hauser MJB, Bernarding J, Erni D. 2018. Metamaterial-based transmit and receive system for whole-body magnetic resonance imaging at ultra-high magnetic fields. PLoS ONE. 13(1). https://doi.org/10.1371/journal.pone.0191719
Iliadou VV, Ptok M, Grech H, Pedersen ER, Brechmann A, Deggouj N, Kiese-Himmel C, S´liwin´ska-Kowalska M, Nickisch A, Demanez L, Veuillet E, Thai-Van H, Sirimanna T, Callimachou M, Santarelli R, Kuske S, Barajas de Prat JJ, Hedever M, Konukseven O, Veraguth D, Mattsson TS, Martins JH, Bamiou DE. 2018. European 17 countries consensus endorses more approaches to APD than reported in Wilson 2018. International Journal of Audiology. 57(5):395-396. https://doi.org/10.1080/14992027.2018.1442937
Konugolu Venkata Sekar S, Mosca S, Tannert S, Valentini G, Martelli F, Binzoni T, Prokazov Y, Turbin E, Zuschratter W, Erdmann R, Pifferi A. 2018. Time domain diffuse Raman spectrometer based on a TCSPC camera for the depth analysis of diffusive media. Optics Letters. 43(9):2134-2137. https://doi.org/10.1364/OL.43.002134
Lützkendorf R, Heidemann RM, Feiweier T, Luchtmann M, Baecke S, Kaufmann J, Stadler J, Budinger E, Bernarding J. 2018. Mapping fine-scale anatomy of gray matter, white matter, and trigeminal-root region applying spherical deconvolution to high-resolution 7-T diffusion MRI. Magnetic Resonance Materials in Physics, Biology, and Medicine. 31(6):701-713. https://doi.org/10.1007/s10334-018-0705-9
Mannewitz A, Bock J, Kreitz S, Hess A, Goldschmidt J, Scheich H, Braun K. 2018. Comparing brain activity patterns during spontaneous exploratory and cue-instructed learning using single photon-emission computed tomography (SPECT) imaging of regional cerebral blood flow in freely behaving rats. Brain Structure and Function. 223(4):2025-2038. https://doi.org/10.1007/s00429-017-1605-x
Mattern H, Sciarra A, Godenschweger F, Stucht D, Lüsebrink F, Rose G, Speck O. 2018. Prospective motion correction enables highest resolution time-of-flight angiography at 7T. Magnetic Resonance in Medicine. 80(1):248-258. https://doi.org/10.1002/mrm.27033
Mikhaylova M, Bär J, van Bommel B, Schätzle P, YuanXiang PA, Raman R, Hradsky J, Konietzny A, Loktionov EY, Reddy PP, Lopez-Rojas J, Spilker C, Kobler O, Raza SA, Stork O, Hoogenraad CC, Kreutz MR. 2018. Caldendrin Directly Couples Postsynaptic Calcium Signals to Actin Remodeling in Dendritic Spines. Neuron. 97(5):1110-1125.e14. https://doi.org/10.1016/j.neuron.2018.01.046
Peitek N, Siegmund J, Apel S, Kastner C, Parnin C, Bethmann A, Leich T, Saake G, Brechmann A. 2018. A Look into Programmers Heads. IEEE Transactions on Software Engineering. https://doi.org/10.1109/TSE.2018.2863303
Peitek N, Siegmund J, Parnin C, Apel S, Hofmeister J, Brechmann A. 2018. Simultaneous Measurement of Program Comprehension with fMRI and Eye Tracking: A Case Study. In Proceedings of the 12th ACM/IEEE International Symposium on Empirical Software Engineering and Measurement, ESEM 2018. IEEE Computer Society. (IEEE International Symposium on Empirical Software Engineering and Measurement). https://doi.org/10.1145/3239235.3240495
Peitek N. 2018. A neuro-cognitive perspective of program comprehension. In Proceedings - International Conference on Software Engineering. IEEE Computer Society. pp. 496-499. (Proceedings - International Conference on Software Engineering). https://doi.org/10.1145/3183440.3183442
Saumweber T, Rohwedder A, Schleyer M, Eichler K, Chen Y-C, Aso Y, Cardona A, Eschbach C, Kobler O, Voigt A, Durairaja A, Mancini N, Zlatic M, Truman JW, Thum A, Gerber B. 2018. Functional architecture of reward learning in mushroom body extrinsic neurons of larval Drosophila. Nature Communications. 9(1). https://doi.org/10.1038/s41467-018-03130-1
Sekar SKV, Mosca S, Valentini G, Zuschratter W, Erdmann R, Pifferi A. 2018. Compact time domain diffuse raman instrumentation based on a TCSPC camera for depth probing of diffusive media. In Optical Tomography and Spectroscopy, OTS 2018. OSA - The Optical Society. https://doi.org/10.1364/OTS.2018.OTu4D.2
Selezneva E, Gorkin A, Budinger E, Brosch M. 2018. Neuronal correlates of auditory streaming in the auditory cortex of behaving monkeys. European Journal of Neuroscience. 48(10):3234-3245. https://doi.org/10.1111/ejn.14098
Siegert I, Lotz AF, Egorow O, Wolff S. 2018. Utilizing Psychoacoustic Modeling to Improve Speech-Based Emotion Recognition. Potapova R, Jokisch O, Karpov A, editors. In Speech and Computer - 20th International Conference, SPECOM 2018, Proceedings. Springer Verlag. pp. 625-635. (Lecture Notes in Computer Science). https://doi.org/10.1007/978-3-319-99579-3_64
2017
Angenstein N, Brechmann A. 2017. Effect of sequential comparison on active processing of sound duration. Human Brain Mapping. 38(9):4459-4469. https://doi.org/10.1002/hbm.23673
Angus DJ, Latham AJ, Harmon-Jones E, Deliano M, Balleine B, Braddon-Mitchell D. 2017. Electrocortical components of anticipation and consumption in a monetary incentive delay task. Psychophysiology. 54(11):1686-1705. https://doi.org/10.1111/psyp.12913
Bhattacharya S, Herrera-Molina R, Sabanov V, Ahmed T, Iscru E, Stöber F, Richter K, Fischer KD, Angenstein F, Goldschmidt J, Beesley PW, Balschun D, Smalla KH, Gundelfinger ED, Montag D. 2017. Genetically induced retrograde amnesia of associative memories after neuroplastin ablation. Biological Psychiatry. 81(2):124-135. https://doi.org/10.1016/j.biopsych.2016.03.2107
Helbing C, Tischmeyer W, Angenstein F. 2017. Late effect of dopamine D1/5 receptor activation on stimulus-induced BOLD responses in the hippocampus and its target regions depends on the history of previous stimulations. NeuroImage. 152:119-129. https://doi.org/10.1016/j.neuroimage.2017.02.077
Herrera-Molina R, Mlinac-Jerkovic K, Ilic K, Stöber F, Vemula SK, Sandoval M, Milosevic NJ, Simic G, Smalla KH, Goldschmidt J, Bognar SK, Montag D. 2017. Neuroplastin deletion in glutamatergic neurons impairs selective brain functions and calcium regulation: Implication for cognitive deterioration. Scientific Reports. 7(1). https://doi.org/10.1038/s41598-017-07839-9
Iliadou V, Ptok M, Grech H, Pedersen ER, Brechmann A, Deggouj N, Kiese-Himmel C, Sliwinska-Kowalska M, Nickisch A, Demanez L, Veuillet E, Thai-Van H, Sirimanna T, Callimachou M, Santarelli R, Kuske S, Barajas J, Hedjever M, Konukseven O, Veraguth D, Mattsson TS, Martins JH, Bamiou DE. 2017. A European perspective on auditory processing disorder-current knowledge and future research focus. Frontiers in Neurology. 8(NOV). https://doi.org/10.3389/fneur.2017.00622
In MH, Posnansky O, Speck O. 2017. High-resolution distortion-free diffusion imaging using hybrid spin-warp and echo-planar PSF-encoding approach. NeuroImage. 148:20-30. https://doi.org/10.1016/j.neuroimage.2017.01.008
Junghans C, Vukojević V, Tavraz NN, Maksimov EG, Zuschratter W, Schmitt FJ, Friedrich T. 2017. Disruption of Ankyrin B and Caveolin-1 Interaction Sites Alters Na+,K+-ATPase Membrane Diffusion. Biophysical Journal. 113(10):2249-2260. https://doi.org/10.1016/j.bpj.2017.08.053
Klasvogt S, Zuschratter W, Schmidt A, Kröber A, Vorwerk S, Wolter R, Isermann B, Wimmers K, Rothkötter HJ, Nossol C. 2017. Air-liquid interface enhances oxidative phosphorylation in intestinal epithelial cell line IPEC-J2. Cell Death Discovery. 3:17001. https://doi.org/10.1038/cddiscovery.2017.1
Korthals M, Langnaese K, Smalla KH, Kähne T, Herrera-Molina R, Handschuh J, Lehmann AC, Mamula D, Naumann M, Seidenbecher C, Zuschratter W, Tedford K, Gundelfinger ED, Montag D, Fischer KD, Thomas U. 2017. A complex of Neuroplastin and Plasma Membrane Ca2+ ATPase controls T cell activation. Scientific Reports. 7(1). https://doi.org/10.1038/s41598-017-08519-4
Low T, Bubalo N, Gossen T, Kotzyba M, Brechmann A, Huckauf A, Nürnberger A. 2017. Towards identifying user intentions in exploratory search using gaze and pupil tracking. In CHIIR 2017 - Proceedings of the 2017 Conference Human Information Interaction and Retrieval . Association for Computing Machinery, Inc. pp. 273-276. https://doi.org/10.1145/3020165.3022131
Maldonado H, Calderon C, Burgos-Bravo F, Kobler O, Zuschratter W, Ramirez O, Härtel S, Schneider P, Quest AFG, Herrera-Molina R, Leyton L. 2017. Astrocyte-to-neuron communication through integrin-engaged Thy-1/CBP/Csk/Src complex triggers neurite retraction via the RhoA/ROCK pathway. Biochimica et Biophysica Acta - Molecular Cell Research. 1864(2):243-254. https://doi.org/10.1016/j.bbamcr.2016.11.006
Parnin C, Siegmund J, Peitek N. 2017. On the Nature of Programmer Expertise. In 28th Annual Workshop of the Psychology of Programming Interest Group (PPIG).
Philipsen L, Reddycherla AV, Hartig R, Gumz J, Kästle M, Kritikos A, Poltorak MP, Prokazov Y, Turbin E, Weber A, Zuschratter W, Schraven B, Simeoni L, Müller AJ. 2017. De novo phosphorylation and conformational opening of the tyrosine kinase Lck act in concert to initiate T cell receptor signaling. Science Signaling. 10(462). https://doi.org/10.1126/scisignal.aaf4736
Pöttker B, Stöber F, Hummel R, Angenstein F, Radyushkin K, Goldschmidt J, Schäfer MKE. 2017. Traumatic brain injury causes long-term behavioral changes related to region-specific increases of cerebral blood flow. Brain Structure and Function. 222(9):4005-4021. https://doi.org/10.1007/s00429-017-1452-9
Prezenski S, Brechmann A, Wolff S, Russwinkel N. 2017. A cognitive modeling approach to strategy formation in dynamic decision making. Frontiers in Psychology. 8(AUG). https://doi.org/10.3389/fpsyg.2017.01335
Riemann S, Helbing C, Angenstein F. 2017. From unspecific to adjusted, how the BOLD response in the rat hippocampus develops during consecutive stimulations. Journal of Cerebral Blood Flow and Metabolism. 37(2):590-604. https://doi.org/10.1177/0271678X16634715
Scherf T, Angenstein F. 2017. Hippocampal CA3 activation alleviates fMRI-BOLD responses in the rat prefrontal cortex induced by electrical VTA stimulation. PLoS ONE. 12(2). https://doi.org/10.1371/journal.pone.0172926
Schulz J, Rohracker M, Stiebler M, Goldschmidt J, Stöber F, Noriega M, Pethe A, Lukas M, Osterkamp F, Reineke U, Höhne A, Smerling C, Amthauer H. 2017. Proof of therapeutic efficacy of a 177Lu-labeled neurotensin receptor 1 antagonist in a colon carcinoma xenograft model. Journal of Nuclear Medicine. 58(6):936-941. https://doi.org/10.2967/jnumed.116.185140
Siegmund J, Peitek N, Parnin C, Apel S, Hofmeister J, Kästner C, Begel A, Bethmann A, Brechmann A. 2017. Measuring Neural Efficiency of Program Comprehension. In Proceedings of the 2017 11th Joint Meeting on Foundations of Software Engineering. AMC Press. pp. 140-150.
Töpperwien M, Krenkel M, Vincenz D, Stöber F, Oelschlegel AM, Goldschmidt J, Salditt T. 2017. Three-dimensional mouse brain cytoarchitecture revealed by laboratory-based x-ray phase-contrast tomography. Scientific Reports. 7. https://doi.org/10.1038/srep42847
Vincenz D, Wernecke KEA, Fendt M, Goldschmidt J. 2017. Habenula and interpeduncular nucleus differentially modulate predator odor-induced innate fear behavior in rats. Behavioural Brain Research. 332:164-171. https://doi.org/10.1016/j.bbr.2017.05.053
Wagner M, Baer C, Zuschratter W, Riek-Burchardt M, Deffge C, Weinert S, Lee JC, Braun-Dullaeus RC, Herold J. 2017. Intravital Microscopy of Monocyte Homing and Tumor-Related Angiogenesis in a Murine Model of Peripheral Arterial Disease. Journal of Visualized Experiments. (126). https://doi.org/10.3791/56290
Weber A, Prokazov Y, Zuschratter W, Hauser MJB. 2017. From synchronised to desynchronised glycolytic oscillations in individual yeast cells. Müller SC, Plath PJ, Radons G, Fuchs A, editors. In Complexity and Synergetics. Springer. pp. 239-254. (Complexity and Synergetics). https://doi.org/10.1007/978-3-319-64334-2_19
Yakupov R, Lei J, Hoffmann MB, Speck O. 2017. False fMRI activation after motion correction. Human Brain Mapping. 38(9):4497-4510. https://doi.org/10.1002/hbm.23677
Yarach U, In MH, Chatnuntawech I, Bilgic B, Godenschweger F, Mattern H, Sciarra A, Speck O. 2017. Model-based iterative reconstruction for single-shot EPI at 7T. Magnetic Resonance in Medicine. 78(6):2250-2264. https://doi.org/10.1002/mrm.26633
Zhao B, Meka DP, Scharrenberg R, König T, Schwanke B, Kobler O, Windhorst S, Kreutz MR, Mikhaylova M, Calderon De Anda F. 2017. Microtubules Modulate F-actin Dynamics during Neuronal Polarization. Scientific Reports. 7(1). https://doi.org/10.1038/s41598-017-09832-8
2016
Angenstein N, Stadler J, Brechmann A. 2016. Auditory intensity processing: Effect of MRI background noise. Hearing Research. 333:87-92. https://doi.org/10.1016/j.heares.2016.01.007
Deike S, Deliano M, Brechmann A. 2016. Probing neural mechanisms underlying auditory stream segregation in humans by transcranial direct current stimulation (tDCS). Neuropsychologia. 91:262-267. https://doi.org/10.1016/j.neuropsychologia.2016.08.017
Deliano M, Tabelow K, König R, Polzehl J. 2016. Improving accuracy and temporal resolution of learning curve estimation for within- and across-session analysis. PLoS ONE. 11(6):Article e0157355. https://doi.org/10.1371/journal.pone.0157355
Ferrando-May E, Hartmann H, Reymann J, Ansari N, Utz N, Fried HU, Kukat C, Peychl J, Liebig C, Terjung S, Laketa V, Sporbert A, Weidtkamp-Peters S, Schauss A, Zuschratter W, Avilov S. 2016. Advanced light microscopy core facilities: Balancing service, science and career. Microscopy Research and Technique. 79(6):463-479. https://doi.org/10.1002/jemt.22648
Godenschweger F, Kägebein U, Stucht D, Yarach U, Sciarra A, Yakupov R, Lüsebrink F, Schulze P, Speck O. 2016. Motion correction in MRI of the brain. Physics in Medicine and Biology. 61(5):R32-R56. https://doi.org/10.1088/0031-9155/61/5/R32
Hanke M, Adelhöfer N, Kottke D, Iacovella V, Sengupta A, Kaule FR, Nigbur R, Waite AQ, Baumgartner F, Stadler J. 2016. A studyforrest extension, simultaneous fMRI and eye gaze recordings during prolonged natural stimulation. Scientific data. 3:Article 160092. https://doi.org/10.1038/sdata.2016.92
In MH, Posnansky O, Speck O. 2016. PSF mapping-based correction of eddy-current-induced distortions in diffusion-weighted echo-planar imaging. Magnetic Resonance in Medicine. 75(5):2055-2063. https://doi.org/10.1002/mrm.25746
Jarvers C, Brosch T, Brechmann A, Woldeit ML, Schulz AL, Ohl FW, Lommerzheim M, Neumann H. 2016. Reversal learning in humans and gerbils: Dynamic control network facilitates learning. Frontiers in Neuroscience. 10(NOV):Article 535. https://doi.org/10.3389/fnins.2016.00535
Kohrs C, Angenstein N, Brechmann A. 2016. Delays in human-computer interaction and their effects on brain activity. PLoS ONE. 11(1):Article e0146250. https://doi.org/10.1371/journal.pone.0146250
Medunjanin S, Schleithoff L, Fiegehenn C, Weinert S, Zuschratter W, Braun-Dullaeus RC. 2016. GSK-3β controls NF-kappaB activity via IKKγ/NEMO. Scientific Reports. 6:Article 38553. https://doi.org/10.1038/srep38553
Mikhaylova M, Bera S, Kobler O, Frischknecht R, Kreutz MR. 2016. A Dendritic Golgi Satellite between ERGIC and Retromer. Cell Reports. 14(2):189-199. https://doi.org/10.1016/j.celrep.2015.12.024
Radtke-Schuller S, Schuller G, Angenstein F, Grosser OS, Goldschmidt J, Budinger E. 2016. Brain atlas of the Mongolian gerbil (Meriones unguiculatus) in CT/MRI-aided stereotaxic coordinates. Brain Structure and Function. 221 Suppl 1(Suppl. 1):1-272. https://doi.org/10.1007/s00429-016-1259-0
Rösner D, Hazer-Rau D, Kohrs C, Bauer T, Günther S, Hoffmann H, Zhang L, Brechmann A. 2016. Is there a biological basis for success in human companion interaction? Results from a transsituational study. in Human-Computer Interaction. Theory, Design, Development and Practice. Springer Verlag. S. 77-88. (Lecture Notes in Computer Science). https://doi.org/10.1007/978-3-319-39510-4_8
Schulz J, Rohracker M, Stiebler M, Goldschmidt J, Grosser OS, Osterkamp F, Pethe A, Reineke U, Smerling C, Amthauer H. 2016. Comparative evaluation of the biodistribution profiles of a series of nonpeptidic neurotensin receptor-1 antagonists reveals a promising candidate for theranostic applications. Journal of Nuclear Medicine. 57(7):1120-1123. https://doi.org/10.2967/jnumed.115.170530
Sengupta A, Kaule FR, Guntupalli JS, Hoffmann MB, Häusler C, Stadler J, Hanke M. 2016. A studyforrest extension, retinotopic mapping and localization of higher visual areas. Scientific data. 3:Article 160093. https://doi.org/10.1038/sdata.2016.93
Spilker C, Nullmeier S, Grochowska KM, Schumacher A, Butnaru I, Macharadze T, Gomes GM, YuanXiang P, Bayraktar G, Rodenstein C, Geiseler C, Kolodziej A, Lopez-Rojas J, Montag D, Angenstein F, Bär J, D’Hanis W, Roskoden T, Mikhaylova M, Budinger E, Ohl FW, Stork O, Zenclussen AC, Karpova A, Schwegler H, Kreutz MR. 2016. A Jacob/Nsmf Gene Knockout Results in Hippocampal Dysplasia and Impaired BDNF Signaling in Dendritogenesis. PLoS Genetics. 12(3):Article e1005907. https://doi.org/10.1371/journal.pgen.1005907
Tran VL, Génot V, Audibert J-F, Prokazov Y, Turbin E, Zuschratter W, Kim H-J, Jung C, Park SY, Pansu RB. 2016. Nucleation and growth during a fluorogenic precipitation in a micro-flow mapped by fluorescence lifetime microscopy. New Journal of Chemistry. 40(5):4601-4605. https://doi.org/10.1039/c5nj03400k
Vogel H, Wolf S, Rabasa C, Rodriguez-Pacheco F, Babaei CS, Stöber F, Goldschmidt J, DiMarchi RD, Finan B, Tschöp MH, Dickson SL, Schürmann A, Skibicka KP. 2016. GLP-1 and estrogen conjugate acts in the supramammillary nucleus to reduce food-reward and body weight. Neuropharmacology. 110:396-406. https://doi.org/10.1016/j.neuropharm.2016.07.039
Yarach U, Luengviriya C, Stucht D, Godenschweger F, Schulze P, Speck O. 2016. Correction of B0-induced geometric distortion variations in prospective motion correction for 7T MRI. Magnetic Resonance Materials in Physics, Biology, and Medicine. 29(3):319-332. https://doi.org/10.1007/s10334-015-0515-2
2015
Angenstein N, Brechmann A. 2015. Auditory intensity processing: Categorization versus comparison. NeuroImage. 119:362-370. https://doi.org/10.1016/j.neuroimage.2015.06.074
Baecke S, Lützkendorf R, Mallow J, Luchtmann M, Tempelmann C, Stadler J, Bernarding J. 2015. A proof-of-principle study of multi-site real-time functional imaging at 3T and 7T: Implementation and validation. Scientific Reports. 5:8413. https://doi.org/10.1038/srep08413
Budinger E, Brechmann A, Brosch M, Heil P, König R, Ohl FW, Scheich H. 2015. Auditory cortex 2014 - towards a synthesis of human and animal research. European Journal of Neuroscience. 41(5):515-517. https://doi.org/10.1111/ejn.12832
Deike S, Heil P, Böckmann-Barthel M, Brechmann A. 2015. Decision making and ambiguity in auditory stream segregation. Frontiers in Neuroscience. 9(JUL):Article 266. https://doi.org/10.3389/fnins.2015.00266
Erdmann I, Marter K, Kobler O, Niehues S, Abele J, Müller A, Bussmann J, Storkebaum E, Ziv T, Thomas U, Dieterich DC. 2015. Cell-selective labelling of proteomes in Drosophila melanogaster. Nature Communications. 6:Article 7521. https://doi.org/10.1038/ncomms8521
Fidzinski P, Korotkova T, Heidenreich M, Maier N, Schuetze S, Kobler O, Zuschratter W, Schmitz D, Ponomarenko A, Jentsch TJ. 2015. KCNQ5 K+ channels control hippocampal synaptic inhibition and fast network oscillations. Nature Communications. 6:Article 7254. https://doi.org/10.1038/ncomms7254
Hanke M, Dinga R, Häusler C, Guntupalli JS, Casey M, Kaule FR, Stadler J. 2015. High-resolution 7-Tesla fMRI data on the perception of musical genres – an extension to the studyforrest dataset. F1000Research. https://doi.org/10.12688/f1000research.6679.1
Happel MFK, Deliano M, Ohl FW. 2015. Combined shuttle-box training with electrophysiological cortex recording and stimulation as a tool to study perception and learning. Journal of Visualized Experiments. 2015(105):Article e53002. https://doi.org/10.3791/53002
Henschke JU, Noesselt T, Scheich H, Budinger E. 2015. Possible anatomical pathways for short-latency multisensory integration processes in primary sensory cortices. Brain Structure and Function. 220(2):955-977. https://doi.org/10.1007/s00429-013-0694-4
Herrmann T, Mallow J, Plaumann M, Luchtmann M, Stadler J, Mylius J, Brosch M, Bernarding J. 2015. The travelling-wave Primate System: A new solution for magnetic resonance imaging of macaque monkeys at 7 tesla ultra-high field. PLoS ONE. 10(6):Article e0129371. https://doi.org/10.1371/journal.pone.0129371
In MH, Posnansky O, Beall EB, Lowe MJ, Speck O. 2015. Distortion correction in EPI using an extended PSF method with a reversed phase gradient approach. PLoS ONE. 10(2):Article e0116320. https://doi.org/10.1371/journal.pone.0116320
Janitzky K, Lippert MT, Engelhorn A, Tegtmeier J, Goldschmidt J, Heinze HJ, Ohl FW. 2015. Optogenetic silencing of locus coeruleus activity in mice impairs cognitive flexibility in an attentional set-shifting task. Frontiers in Behavioral Neuroscience. 9(NOVEMBER):Article 286. https://doi.org/10.3389/fnbeh.2015.00286
Krippl M, Karim AA, Brechmann A. 2015. Neuronal correlates of voluntary facial movements. Frontiers in Human Neuroscience. 9(OCTOBER):Article 598. https://doi.org/10.3389/fnhum.2015.00598
Mallow J, Bernarding J, Luchtmann M, Bethmann A, Brechmann A. 2015. Superior memorizers employ different neural networks for encoding and recall. Frontiers in Systems Neuroscience. 9(September):Article A128. https://doi.org/10.3389/fnsys.2015.00128
Medunjanin S, Daniel JM, Weinert S, Dutzmann J, Burgbacher F, Brecht S, Bruemmer D, Kähne T, Naumann M, Sedding DG, Zuschratter W, Braun-Dullaeus RC. 2015. DNA-dependent protein kinase (DNA-PK) permits vascular smooth muscle cell proliferation through phosphorylation of the orphan nuclear receptor NOR1. Cardiovascular Research. 106(3):488-497. https://doi.org/10.1093/cvr/cvv126
Nossol C, Barta-Böszörményi A, Kahlert S, Zuschratter W, Faber-Zuschratter H, Reinhardt N, Ponsuksili S, Wimmers K, Diesing A, Rothkötter HJ. 2015. Comparing two intestinal porcine epithelial cell lines (IPECs): Morphological differentiation, function and metabolism. PLoS ONE. 10(7):Article e132323. https://doi.org/10.1371/journal.pone.0132323
Rothe T, Deliano M, Wójtowicz AM, Dvorzhak A, Harnack D, Paul S, Vagner T, Melnick I, Stark H, Grantyn R. 2015. Pathological gamma oscillations, impaired dopamine release, synapse loss and reduced dynamic range of unitary glutamatergic synaptic transmission in the striatum of hypokinetic Q175 Huntington mice. Neuroscience. 311:519-538. https://doi.org/10.1016/j.neuroscience.2015.10.039
Scherf T, Angenstein F. 2015. Postsynaptic and spiking activity of pyramidal cells, the principal neurons in the rat hippocampal CA1 region, does not control the resultant BOLD response: A combined electrophysiologic and fMRI approach. Journal of Cerebral Blood Flow and Metabolism. 35(4):565-575. https://doi.org/10.1038/jcbfm.2014.252
Specht K, Baumgartner FJ, Stadler J, Hugdahl K, Pollmann S. 2015. Functional asymmetry and effective connectivity of the auditory system during speech perception is modulated by the place of articulation of the consonant – A 7 T fMRI study. in LATERALIZATION AND COGNITIVE SYSTEMS. Frontiers Media S. A. S. 180-189. https://doi.org/10.3389/978-2-88919-411-7
Stucht D, Danishad KA, Schulze P, Godenschweger F, Zaitsev M, Speck O. 2015. Highest resolution in vivo human brain MRI using prospective motion correction. PLoS ONE. 10(7):e0133921. https://doi.org/10.1371/journal.pone.0133921
Wanger T, Wetzel W, Scheich H, Ohl FW, Goldschmidt J. 2015. Spatial patterns of neuronal activity in rat cerebral cortex during non-rapid eye movement sleep. Brain Structure and Function. 220(6):3469-3484. https://doi.org/10.1007/s00429-014-0867-9
Wernecke KEA, Vincenz D, Storsberg S, D'Hanis W, Goldschmidt J, Fendt M. 2015. Fox urine exposure induces avoidance behavior in rats and activates the amygdalar olfactory cortex. Behavioural Brain Research. 279:76-81. https://doi.org/10.1016/j.bbr.2014.11.020
Wolff S, Brechmann A. 2015. Carrot and stick 2.0: The benefits of natural and motivational prosody in computer-assisted learning. Computers in Human Behavior. 43:76-84. https://doi.org/10.1016/j.chb.2014.10.015
Yarach U, Luengviriya C, Danishad A, Stucht D, Godenschweger F, Schulze P, Speck O. 2015. Correction of gradient nonlinearity artifacts in prospective motion correction for 7T MRI. Magnetic Resonance in Medicine. 73(4):1562-1569. https://doi.org/10.1002/mrm.25283
2014
Angenstein F. 2014. The actual intrinsic excitability of granular cells determines the ruling neurovascular coupling mechanism in the rat dentate gyrus. Journal of Neuroscience. 34(25):8529-8545. https://doi.org/10.1523/JNEUROSCI.0472-14.2014
Bethmann A, Brechmann A. 2014. On the definition and interpretation of voice selective activation in the temporal cortex. Frontiers in Human Neuroscience. 8(JULY):Article 499. https://doi.org/10.3389/fnhum.2014.00499
Böckmann-Barthel M, Deike S, Brechmann A, Ziese M, Verhey JL. 2014. Time course of auditory streaming: Do CI users differ from normal-hearing listeners?. Frontiers in Psychology. 5(JUL):Article 775. https://doi.org/10.3389/fpsyg.2014.00775
Braun J, Guo J, Lützkendorf R, Stadler J, Papazoglou S, Hirsch S, Sack I, Bernarding J. 2014. High-resolution mechanical imaging of the human brain by three-dimensional multifrequency magnetic resonance elastography at 7T. NeuroImage. 90:308-314. https://doi.org/10.1016/j.neuroimage.2013.12.032
Budinger E, Hrsg. 2014. Towards a Synthesis of Human and Animal Research: Proceedings of the 5th International Conference on Auditory Cortex. Magdeburg, Germany: Docupoint Verlag. 158 S.
Dolležal LV, Brechmann A, Klump GM, Deike S. 2014. Evaluating auditory stream segregation of SAM tone sequences by subjective and objective psychoacoustical tasks, and brain activity. Frontiers in Neuroscience. 8(8 JUN):Article 119. https://doi.org/10.3389/fnins.2014.00119
Hanke M, Baumgartner FJ, Ibe P, Kaule FR, Pollmann S, Speck O, Zinke W, Stadler J. 2014. A high-resolution 7-Tesla fMRI dataset from complex natural stimulation with an audio movie. Scientific data. 1:Article 140003. https://doi.org/10.1038/sdata.2014.3
Happel MFK, Deliano M, Handschuh J, Ohl FW. 2014. Dopamine-modulated recurrent corticoefferent feedback in primary sensory cortex promotes detection of behaviorally relevant stimuli. Journal of Neuroscience. 34(4):1234-1247. https://doi.org/10.1523/JNEUROSCI.1990-13.2014
Happel MFK, Niekisch H, Castiblanco Rivera LL, Ohl FW, Deliano M, Frischknecht R. 2014. Enhanced cognitive flexibility in reversal learning induced by removal of the extracellular matrix in auditory cortex. Proceedings of the National Academy of Sciences of the United States of America. 111(7):2800-2805. https://doi.org/10.1073/pnas.1310272111
Hartig R, Prokazov Y, Turbin E, Zuschratter W. 2014. Wide-Field fluorescence lifetime imaging with multi-anode detectors. in Fluorescence Spectroscopy and Microscopy: Methods and Protocols. Humana Press Inc. S. 457-480. (Methods in Molecular Biology). https://doi.org/10.1007/978-1-62703-649-8_20
Hunger M, Budinger E, Zhong K, Angenstein F. 2014. Visualization of acute focal lesions in rats with experimental autoimmune encephalomyelitis by magnetic nanoparticles, comparing different MRI sequences including phase imaging. Journal of Magnetic Resonance Imaging. 39(5):1126-1135. https://doi.org/10.1002/jmri.24280
Kanowski M, Voges J, Buentjen L, Stadler J, Heinze HJ, Tempelmann C. 2014. Direct visualization of anatomic subfields within the superior aspect of the human lateral thalamus by MRI at 7T. American Journal of Neuroradiology. 35(9):1721-1727. https://doi.org/10.3174/ajnr.A3951
Kaule FR, Wolynski B, Gottlob I, Stadler J, Speck O, Kanowski M, Meltendorf S, Behrens-Baumann W, Hoffmann MB. 2014. Impact of chiasma opticum malformations on the organization of the human ventral visual cortex. Human Brain Mapping. 35(10):5093-5105. https://doi.org/10.1002/hbm.22534
Koch N, Kobler O, Thomas U, Qualmann B, Kessels MM. 2014. Terminal axonal arborization and synaptic bouton formation critically rely on Abp1 and the Arp2/3 complex. PLoS ONE. 9(5):Article e97692. https://doi.org/10.1371/journal.pone.0097692
Kohrs C, Hrabal D, Angenstein N, Brechmann A. 2014. Delayed system response times affect immediate physiology and the dynamics of subsequent button press behavior. Psychophysiology. 51(11):1178-1184. https://doi.org/10.1111/psyp.12253
Kolodziej A, Lippert M, Angenstein F, Neubert J, Pethe A, Grosser OS, Amthauer H, Schroeder UH, Reymann KG, Scheich H, Ohl FW, Goldschmidt J. 2014. SPECT-imaging of activity-dependent changes in regional cerebral blood flow induced by electrical and optogenetic self-stimulation in mice. NeuroImage. 103:171-180. https://doi.org/10.1016/j.neuroimage.2014.09.023
Lison H, Happel MFK, Schneider F, Baldauf K, Kerbstat S, Seelbinder B, Schneeberg J, Zappe M, Goldschmidt J, Budinger E, Schröder UH, Ohl FW, Schilling S, Demuth HU, Scheich H, Reymann KG, Rönicke R. 2014. Disrupted cross-laminar cortical processing in β amyloid pathology precedes cell death. Neurobiology of Disease. 63:62-73. https://doi.org/10.1016/j.nbd.2013.11.014
Mikhaylova M, Karpova A, Bär J, Bethge P, YuanXiang P, Chen Y, Zuschratter W, Behnisch T, Kreutz MR. 2014. Cellular distribution of the NMDA-receptor activated synapto-nuclear messenger Jacob in the rat brain. Brain Structure and Function. 219(3):843-860. https://doi.org/10.1007/s00429-013-0539-1
Prokazov Y, Turbin E, Weber A, Hartig R, Zuschratter W. 2014. Position sensitive detector for fluorescence lifetime imaging. Journal of Instrumentation. 9(12):Article C12015. https://doi.org/10.1088/1748-0221/9/12/C12015
Rauschenberg J, Nagel AM, Ladd SC, Theysohn JM, Ladd ME, Möller HE, Trampel R, Turner R, Pohmann R, Scheffler K, Brechmann A, Stadler J, Felder J, Shah NJ, Semmler W. 2014. Multicenter study of subjective acceptance during magnetic resonance imaging at 7 and 9.4 T. Investigative Radiology. 49(5):249-259. https://doi.org/10.1097/RLI.0000000000000035
Rehberg K, Kliche S, Madencioglu DA, Thiere M, Müller B, Manuel Meineke B, Freund C, Budinger E, Stork O. 2014. The serine/threonine kinase Ndr2 controls integrin trafficking and integrin-dependent neurite growth. Journal of Neuroscience. 34(15):5342-5354. https://doi.org/10.1523/JNEUROSCI.2728-13.2014
Saldeitis K, Happel MFK, Ohl FW, Scheich H, Budinger E. 2014. Anatomy of the auditory thalamocortical system in the mongolian gerbil: Nuclear origins and cortical field-, layer-, and frequency-specificities. Journal of Comparative Neurology. 522(10):2397-2430. https://doi.org/10.1002/cne.23540
Seidensticker M, Ulrich G, Muehlberg FL, Pethe A, Grosser OS, Steffen IG, Stiebler M, Goldschmidt J, Smalla KH, Seidensticker R, Ricke J, Amthauer H, Mohnike K. 2014. Tumor cell uptake of 99mTc-Labeled 1-Thio-β-d-glucose and 5-thio-d-glucose in comparison with 2-deoxy-2-[18 f]fluoro-d-glucose in vitro: Kinetics, dependencies, blockage and cell compartment of accumulation. Molecular Imaging and Biology. 16(2):189-198. https://doi.org/10.1007/s11307-013-0690-3
Siegmund J, Kästner C, Apel S, Parnin C, Bethmann A, Leich T, Saake G, Brechmann A. 2014. Understanding understanding source code with functional magnetic resonance imaging. in ICSE 2014 Proceedings of the 36th International Conference on Software Engineering . 1 Aufl. ACM. S. 378-389. https://doi.org/10.1145/2568225.2568252
Specht K, Baumgartner F, Stadler J, Hugdahl K, Pollmann S. 2014. Functional asymmetry and effective connectivity of the auditory system during speech perception is modulated by the place of articulation of the consonant: A 7T fMRI study. Frontiers in Psychology. 5:549. https://doi.org/10.3389/fpsyg.2014.00549
Stöber F, Baldauf K, Ziabreva I, Harhausen D, Zille M, Neubert J, Reymann KG, Scheich H, Dirnagl U, Schröder UH, Wunder A, Goldschmidt J. 2014. Single-cell resolution mapping of neuronal damage in acute focal cerebral ischemia using thallium autometallography. Journal of Cerebral Blood Flow and Metabolism. 34(1):144-152. https://doi.org/10.1038/jcbfm.2013.177
Wasserthal C, Brechmann A, Stadler J, Fischl B, Engel K. 2014. Localizing the human primary auditory cortex in vivo using structural MRI. NeuroImage. 93 Pt 2(P1):237-251. https://doi.org/10.1016/j.neuroimage.2013.07.046
2013
Angenstein F, Krautwald K, Wetzel W, Scheich H. 2013. Perforant pathway stimulation as a conditioned stimulus for active avoidance learning triggers BOLD responses in various target regions of the hippocampus: A combined fMRI and electrophysiological study. NeuroImage. 75:213-227. https://doi.org/10.1016/j.neuroimage.2013.03.007
Angenstein N, Brechmann A. 2013. Division of labor between left and right human auditory cortices during the processing of intensity and duration. NeuroImage. 83:1-11. https://doi.org/10.1016/j.neuroimage.2013.06.071
Angenstein N, Brechmann A. 2013. Left auditory cortex is involved in pairwise comparisons of the direction of frequency modulated tones. Frontiers in Neuroscience. 7(7 JUL):Article Article 115. https://doi.org/10.3389/fnins.2013.00115
Bonath B, Tyll S, Budinger E, Krauel K, Hopf JM, Noesselt T. 2013. Task-demands and audio-visual stimulus configurations modulate neural activity in the human thalamus. NeuroImage. 66:110-118. https://doi.org/10.1016/j.neuroimage.2012.10.018
Brosch M, Budinger E, Scheich H. 2013. Different Synchronization Rules in Primary and Nonprimary Auditory Cortex of Monkeys. Journal of Cognitive Neuroscience. 25(9):1517-1526. https://doi.org/10.1162/jocn_a_00413
Budinger E, Brosch M, Scheich H, Mylius J. 2013. The subcortical auditory structures in the Mongolian gerbil: II. Frequency-related topography of the connections with cortical field AI. Journal of Comparative Neurology. 521(12):2772-2797. https://doi.org/10.1002/cne.23314
Deliano M. 2013. On the intimate relationship between Man and Machine. Epistemology & Philosophy of Science. Alfa-M. S. 141-163.
Diesing AK, Nossol C, Faber-Zuschratter H, Zuschratter W, Renner L, Sokolova O, Naumann M, Rothkötter HJ. 2013. Rapid interaction of helicobacter pylori with microvilli of the polar human gastric epithelial cell line NCI-N87. Anatomical Record. 296(12):1800-1805. https://doi.org/10.1002/ar.22818
Helbing C, Werner G, Angenstein F. 2013. Variations in the temporal pattern of perforant pathway stimulation control the activity in the mesolimbic pathway. NeuroImage. 64(1):43-60. https://doi.org/10.1016/j.neuroimage.2012.09.001
Hrabal D, Kohrs C, Brechmann A, Tan JW, Rukavina S, Traue HC. 2013. Physiological effects of delayed system response time on skin conductance. in Multimodal Pattern Recognition of Social Signals in Human-Computer-Interaction - First IAPR TC3 Workshop, MPRSS 2012, Revised Selected Papers. Springer Nature. S. 52-62. (Lecture Notes in Computer Science). https://doi.org/10.1007/978-3-642-37081-6_7
Hradsky J, Mikhaylova M, Karpova A, Kreutz MR, Zuschratter W. 2013. Super-resolution microscopy of the neuronal calcium-binding proteins calneuron-1 and caldendrin. in Methods in Molecular Biology. S. 147-169. (Methods in molecular biology (Clifton, N.J.)). https://doi.org/10.1007/978-1-62703-230-8_10
Karpova A, Mikhaylova M, Bera S, Bär J, Reddy PP, Behnisch T, Rankovic V, Spilker C, Bethge P, Sahin J, Kaushik R, Zuschratter W, Kähne T, Naumann M, Gundelfinger ED, Kreutz MR. 2013. Encoding and transducing the synaptic or extrasynaptic origin of NMDA receptor signals to the nucleus. Cell. 152(5):1119-1133. https://doi.org/10.1016/j.cell.2013.02.002
Krautwald K, Min HK, Lee KH, Angenstein F. 2013. Synchronized electrical stimulation of the rat medial forebrain bundle and perforant pathway generates an additive BOLD response in the nucleus accumbens and prefrontal cortex. NeuroImage. 77:14-25. https://doi.org/10.1016/j.neuroimage.2013.03.046
Lützkendorf R, Hertel F, Heidemann R, Thiel A, Luchtmann M, Plaumann M, Stadler J, Baecke S, Bernarding J. 2013. Non-invasive high-resolution tracking of human neuronal pathways: Diffusion tensor imaging at 7T with 1.2 mm isotropic voxel size. in Progress in Biomedical Optics and Imaging. SPIE. https://doi.org/10.1117/12.2006764
Mallow J, Herrmann T, Kim KN, Stadler J, Mylius J, Brosch M, Bernarding J. 2013. Ultra-high field MRI for primate imaging using the travelling-wave concept. Magnetic Resonance Materials in Physics, Biology, and Medicine. 26(4):389-400. https://doi.org/10.1007/s10334-012-0358-z
Mylius J, Brosch M, Scheich H, Budinger E. 2013. Subcortical auditory structures in the mongolian gerbil: I. Golgi architecture. Journal of Comparative Neurology. 521(6):1289-1321. https://doi.org/10.1002/cne.23232
Puschmann S, Brechmann A, Thiel CM. 2013. Learning-dependent plasticity in human auditory cortex during appetitive operant conditioning. Human Brain Mapping. 34(11):2841-2851. https://doi.org/10.1002/hbm.22107
Riedel A, Stöber F, Richter K, Fischer KD, Miettinen R, Budinger E. 2013. VGLUT3-immunoreactive afferents of the lateral septum: Ultrastructural evidence for a modulatory role of glutamate. Brain Structure and Function. 218(1):295-301. https://doi.org/10.1007/s00429-012-0395-4
Sakaba T, Kononenko NL, Bacetic J, Pechstein A, Schmoranzer J, Yao L, Barth H, Shupliakov O, Kobler O, Aktories K, Haucke V. 2013. Fast neurotransmitter release regulated by the endocytic scaffold intersectin. Proceedings of the National Academy of Sciences of the United States of America. 110(20):8266-8271. https://doi.org/10.1073/pnas.1219234110
Schoonderwoert V, Dijkstra R, Luckinavicius G, Kobler O, van der Voort H. 2013. Huygens STED Deconvolution Increases Signal-to-Noise and Image Resolution towards 22 nm. Microscopy Today. 21(06):38 - 44. https://doi.org/10.1017/S1551929513001089
Selezneva E, Deike S, Knyazeva S, Scheich H, Brechmann A, Brosch M. 2013. Rhythm sensitivity in macaque monkeys. Frontiers in Systems Neuroscience. 7(SEP):Article 49. https://doi.org/10.3389/fnsys.2013.00049
Stirnweiss A, Hartig R, Gieseler S, Lindquist JA, Reichardt P, Philipsen L, Simeoni L, Poltorak M, Merten C, Zuschratter W, Prokazov Y, Paster W, Stockinger H, Harder T, Gunzer M, Schraven B. 2013. T cell activation results in conformational changes in the Src family kinase Lck to induce its activation. Science Signaling. 6(263):Article ra13. https://doi.org/10.1126/scisignal.2003607
Szycik GR, Stadler J, Brechmann A, Münte TF. 2013. Preattentive mechanisms of change detection in early auditory cortex: A 7Tesla fMRI study. Neuroscience. 253:100-109. https://doi.org/10.1016/j.neuroscience.2013.08.039
Tacikowski P, Brechmann A, Nowicka A. 2013. Cross-modal pattern of brain activations associated with the processing of self- and significant other's name. Human Brain Mapping. 34(9):2069-2077. https://doi.org/10.1002/hbm.22048
Traue HC, Ohl F, Brechmann A, Schwenker F, Kessler H, Limbrecht K, Hoffmann H, Scherer S, Kotzyba M, Scheck A, Walter S. 2013. A Framework for Emotions and Dispositions in Man-Companion Interaction. In Coverbal Synchrony in Human-Machine Interaction. CRC Press. pp. 99-140. https://citeseerx.ist.psu.edu/viewdoc/download?doi=10.1.1.986.1222&rep=rep1&type=pdf
Vielhaber S, Debska-Vielhaber G, Peeva V, Schoeler S, Kudin AP, Minin I, Schreiber S, Dengler R, Kollewe K, Zuschratter W, Kornblum C, Zsurka G, Kunz WS. 2013. Mitofusin 2 mutations affect mitochondrial function by mitochondrial DNA depletion. Acta Neuropathologica. 125(2):245-256. https://doi.org/10.1007/s00401-012-1036-y
Wanger T, Takagaki K, Lippert MT, Goldschmidt J, Ohl FW. 2013. Wave propagation of cortical population activity under urethane anesthesia is state dependent. Neuroscience. 14:Article 78. https://doi.org/10.1186/1471-2202-14-78
Weis T, Brechmann A, Puschmann S, Thiel CM. 2013. Feedback that confirms reward expectation triggers auditory cortex activity. Journal of Neurophysiology. 110(8):1860-1868. https://doi.org/10.1152/jn.00128.2013
Weis T, Puschmann S, Brechmann A, Thiel CM. 2013. Positive and negative reinforcement activate human auditory cortex. Frontiers in Human Neuroscience. 7(DEC):Article 842. https://doi.org/10.3389/fnhum.2013.00842
Yang S, Yang Z, Fischer K, Zhong K, Stadler J, Godenschweger F, Steiner J, Heinze HJ, Bernstein HG, Bogerts B, Mawrin C, Reutens DC, Speck O, Walter M. 2013. Integration of ultra-high field MRI and histology for connectome based research of brain disorders. Frontiers in Neuroanatomy. 7(SEP):Article 31. https://doi.org/10.3389/fnana.2013.00031
2012
Angenstein N, Scheich H, Brechmann A. 2012. Interaction between bottom-up and top-down effects during the processing of pitch intervals in sequences of spoken and sung syllables. NeuroImage. 61(3):715-722. https://doi.org/10.1016/j.neuroimage.2012.03.086
Apostolova I, Wunder A, Dirnagl U, Michel R, Stemmer N, Lukas M, Derlin T, Gregor-Mamoudou B, Goldschmidt J, Brenner W, Buchert R. 2012. Brain perfusion SPECT in the mouse: Normal pattern according to gender and age. NeuroImage. 63(4):1807-1817. https://doi.org/10.1016/j.neuroimage.2012.08.038
Bethmann A, Scheich H, Brechmann A. 2012. The Temporal Lobes Differentiate between the Voices of Famous and Unknown People: An Event-Related fMRI Study on Speaker Recognition. PLoS ONE. 7(10):e47626. https://doi.org/10.1371/journal.pone.0047626
Budinger E, Heil P. 2012. Anatomy of the auditory cortex. in Listening to Speech: An Auditory Perspective. Taylor & Francis Group. S. 91-113. https://doi.org/10.4324/9780203933107
Deike S, Heil P, Böckmann-Barthel M, Brechmann A. 2012. The build-up of auditory stream segregation: A different perspective. Frontiers in Psychology. 3(OCT):Article Article 461. https://doi.org/10.3389/fpsyg.2012.00461
Esparza J, Scherer S, Brechmann A, Schwenker F. 2012. Automatic emotion classification vs. human perception: Comparing machine performance to the human benchmark. in 2012 11th International Conference on Information Science, Signal Processing and their Applications, ISSPA 2012. S. 1253-1258. https://doi.org/10.1109/ISSPA.2012.6310484
Haroon F, Händel U, Angenstein F, Goldschmidt J, Kreutzmann P, Lison H, Fischer KD, Scheich H, Wetzel W, Schlüter D, Budinger E. 2012. Toxoplasma gondii actively inhibits neuronal function in chronically infected mice. PLoS ONE. 7(4):e35516. https://doi.org/10.1371/journal.pone.0035516
Hoffmann MB, Kaule FR, Levin N, Masuda Y, Kumar A, Gottlob I, Horiguchi H, Dougherty RF, Stadler J, Wolynski B, Speck O, Kanowski M, Liao YJ, Wandell BA, Dumoulin SO. 2012. Plasticity and Stability of the Visual System in Human Achiasma. Neuron. 75(3):393-401. https://doi.org/10.1016/j.neuron.2012.05.026
Kohrs C, Angenstein N, Scheich H, Brechmann A. 2012. Human striatum is differentially activated by delayed, omitted, and immediate registering feedback. Frontiers in Human Neuroscience. 6(AUGUST). https://doi.org/10.3389/fnhum.2012.00243
Krautwald K, Angenstein F. 2012. Low frequency stimulation of the perforant pathway generates anesthesia-specific variations in neural activity and BOLD responses in the rat dentate gyrus. Journal of Cerebral Blood Flow and Metabolism. 32(2):291-305. https://doi.org/10.1038/jcbfm.2011.126
Lovell J, Brosch M, Budinger E, Goldschmidt J, Scheich H, Tschorn S, Wendt B, Zuschratter W. 2012. Scanning and Transmission Electron Microscope Examination of Cochlea Hair and Pillar Cells from the Ear of the Mongolian Gerbil (Meriones unguiculatus). Anatomy and Physiology. 2(3).
Lutti A, Stadler J, Josephs O, Windischberger C, Speck O, Bernarding J, Hutton C, Weiskopf N. 2012. Robust and fast whole brain mapping of the RF transmit field B1 at 7T. PLoS ONE. 7(3):e32379. https://doi.org/10.1371/journal.pone.0032379
Macharadze T, Pielot R, Wanger T, Scheich H, Gundelfinger ED, Budinger E, Goldschmidt J, Kreutz MR. 2012. Altered neuronal activity patterns in the visual cortex of the adult rat after partial optic nerve crush-a single-cell resolution metabolic mapping study. Cerebral Cortex. 22(8):1824-1833. https://doi.org/10.1093/cercor/bhr256
Metzger CD, Eckert U, Steiner J, Sartorius A, Buchmann JE, Stadler J, Tempelmann C, Speck O, Bogerts B, Abler B, Walter M. 2012. High field fMRI reveals thalamocortical integration of segregated cognitive and emotional processing in mediodorsal and intralaminar thalamic nuclei. in BASAL GANGLIA CIRCUITS. Frontiers Media S. A. S. 197-213. https://doi.org/10.3389/978-2-88919-019-5
Schreiber S, Bueche CZ, Garz C, Kropf S, Angenstein F, Goldschmidt J, Neumann J, Heinze HJ, Goertler M, Reymann KG, Braun H. 2012. The pathologic cascade of cerebrovascular lesions in SHRSP: Is erythrocyte accumulation an early phase. Journal of Cerebral Blood Flow and Metabolism. 32(2):278-290. https://doi.org/10.1038/jcbfm.2011.122
Siegmund J, Brechmann A, Apel S, Kästner C, Liebig J, Leich T, Saake G. 2012. Toward measuring program comprehension with functional magnetic resonance imaging. in AMC SIGSOFT. https://doi.org/10.1145/2393596.2393624
Szycik GR, Stadler J, Tempelmann C, Münte TF. 2012. Examining the McGurk illusion using high-field 7 tesla functional MRI. Frontiers in Human Neuroscience. 6(APRIL 2012). https://doi.org/10.3389/fnhum.2012.00095
Tiede R, Krautwald K, Fincke A, Angenstein F. 2012. NMDA-dependent mechanisms only affect the BOLD response in the rat dentate gyrus by modifying local signal processing. Journal of Cerebral Blood Flow and Metabolism. 32(3):570-584. https://doi.org/10.1038/jcbfm.2011.182
Wanger T, Scheich H, Ohl FW, Goldschmidt J. 2012. The use of thallium diethyldithiocarbamate for mapping CNS potassium metabolism and neuronal activity: Tl +-redistribution, Tl +-kinetics and Tl +-equilibrium distribution. Journal of Neurochemistry. 122(1):106-114. https://doi.org/10.1111/j.1471-4159.2012.07757.x
Weber A, Prokazov Y, Zuschratter W, Hauser MJB. 2012. Desynchronisation of Glycolytic Oscillations in Yeast Cell Populations. PLoS ONE. 7(9):e43276. https://doi.org/10.1371/journal.pone.0043276
Weis T, Puschmann S, Brechmann A, Thiel CM. 2012. Effects of L-dopa during Auditory Instrumental Learning in Humans. PLoS ONE. 7(12):e52504. https://doi.org/10.1371/journal.pone.0052504
Wolff S, Brechmann A. 2012. MOTI: A motivational prosody corpus for speech-based tutorial systems. in Proceedings of 10th ITG Symposium on Speech Communication. Institute of Electrical and Electronics Engineers Inc.
You W, Achard S, Stadler J, Brückner B, U. S. 2012. Fractal analysis of resting state functional connectivity of the brain. in 2012 International Joint Conference on Neural Networks, IJCNN 2012. Article 6252657. https://doi.org/10.1109/IJCNN.2012.6252657
2011
Brechmann A, Brosch M, Budinger E, Heil P, König R, Ohl F, Scheich H. 2011. Auditory cortex - Current concepts in human and animal research. Hearing Research. 271(1-2):1-2. https://doi.org/10.1016/j.heares.2010.10.016
Börzsönyi T, Unger T, Szabó B, Wegner S, Angenstein F, Stannarius R. 2011. Reflection and exclusion of shear zones in inhomogeneous granular materials. Soft Matter. 7(18):8330-8336. https://doi.org/10.1039/c1sm05762f
Coomber B, Edwards D, Jones SJ, Shackleton TM, Goldschmidt J, Wallace MN, Palmer AR. 2011. Cortical inactivation by cooling in small animals. Frontiers in Systems Neuroscience. 5(JUNE 2011):53. https://doi.org/10.3389/fnsys.2011.00053
Engel K, Toennies KD, Brechmann A. 2011. Part-based localisation and segmentation of landmark-related auditory cortical regions. Pattern Recognition. 44(9):2017-2033. https://doi.org/10.1016/j.patcog.2010.09.004
Heidt T, Deininger F, Peter K, Goldschmidt J, Pethe A, Hagemeyer CE, Neudorfer I, Zirlik A, Weber WA, Bode C, Meyer PT, Behe M, von zur Mühlen C. 2011. Activated platelets in carotid artery thrombosis in mice can be selectively targeted with a radiolabeled single-chain antibody. PLoS ONE. 6(3):e18446. https://doi.org/10.1371/journal.pone.0018446
Hutton C, Josephs O, Stadler J, Featherstone E, Reid A, Speck O, Bernarding J, Weiskopf N. 2011. The impact of physiological noise correction on fMRI at 7T. NeuroImage. 57(1):101-112. https://doi.org/10.1016/j.neuroimage.2011.04.018
Michaluk P, Wawrzyniak M, Alot P, Szczot M, Wyrembek P, Mercik K, Medvedev N, Wilczek E, De Roo M, Zuschratter W, Muller D, Wilczynski GM, Mozrzymas JW, Stewart MG, Kaczmarek L, Wlodarczyk J. 2011. Influence of matrix metalloproteinase MMP-9 on dendritic spine morphology. Journal of Cell Science. 124(19):3369-3380. https://doi.org/10.1242/jcs.090852
Nowicka A, Marchewka A, Jednoróg K, Tacikowski P, Brechmann A. 2011. Forgetting of emotional information is hard: An fMRI study of directed forgetting. Cerebral Cortex. 21(3):539-549. https://doi.org/10.1093/cercor/bhq117
Scheich H, Brechmann A, Brosch M, Budinger E, Ohl FW, Selezneva E, Stark H, Tischmeyer W, Wetzel W. 2011. Behavioral semantics of learning and crossmodal processing in auditory cortex: The semantic processor concept. Hearing Research. 271(1-2):3-15. https://doi.org/10.1016/j.heares.2010.10.006
Tacikowski P, Brechmann A, Marchewka A, Jednoróg K, Dobrowolny M, Nowicka A. 2011. Is it about the self or the significance? an fMRI study of self-name recognition. Social Neuroscience. 6(1):98-107. https://doi.org/10.1080/17470919.2010.490665
Tyll S, Budinger E, Noesselt T. 2011. Thalamic influences on multisensory integration. Communicative and Integrative Biology. 4(4):378-381. https://doi.org/10.4161/cib.15222
Vitali M, Picazo F, Prokazov Y, Duci A, Turbin E, Götze C, Llopis J, Hartig R, Visser AJWG, Zuschratter W. 2011. Wide-Field multi-parameter FLIM: Long-term minimal invasive observation of proteins in living cells. PLoS ONE. 6(2):e15820. https://doi.org/10.1371/journal.pone.0015820
2010
Angenstein F, Krautwald K, Scheich H. 2010. The current functional state of local neuronal circuits controls the magnitude of a BOLD response to incoming stimuli. NeuroImage. 50(4):1364-1375. https://doi.org/10.1016/j.neuroimage.2010.01.070
Bachmann A, Kobler O, Kittel RJ, Wichmann C, Sierralta J, Sigrist SJ, Gundelfinger ED, Knust E, Thomas U. 2010. A perisynaptic ménage à trois between Dlg, DLin-7, and metro controls proper organization of Drosophila synaptic junctions. Journal of Neuroscience. 30(17):5811-5824. https://doi.org/10.1523/JNEUROSCI.0778-10.2010
Deike S, Scheich H, Brechmann A. 2010. Active stream segregation specifically involves the left human auditory cortex. Hearing Research. 265(1-2):30-37. https://doi.org/10.1016/j.heares.2010.03.005
Goldschmidt J, Wanger T, Engelhorn A, Friedrich H, Happel M, Ilango A, Engelmann M, Stuermer IW, Ohl FW, Scheich H. 2010. High-resolution mapping of neuronal activity using the lipophilic thallium chelate complex TlDDC: Protocol and validation of the method. NeuroImage. 49(1):303-315. https://doi.org/10.1016/j.neuroimage.2009.08.012
Hamhaber U, Klatt D, Papazoglou S, Hollmann M, Stadler J, Sack I, Bernarding J, Braun J. 2010. In vivo magnetic resonance elastography of human brain at 7 T and 1.5 T. Journal of Magnetic Resonance Imaging. 32(3):577-583. https://doi.org/10.1002/jmri.22294
Hammer N, Steinke H, Böhme J, Stadler J, Josten C, Spanel-Borowski K. 2010. Description of the iliolumbar ligament for computer-assisted reconstruction. Annals of Anatomy. 192(3):162-167. https://doi.org/10.1016/j.aanat.2010.02.003
Hammer R, Brechmann A, Ohl F, Weinshall D, Hochstein S. 2010. Differential category learning processes: The neural basis of comparison-based learning and induction. NeuroImage. 52(2):699-709. https://doi.org/10.1016/j.neuroimage.2010.03.080
Herrmann CS, Brechmann A, Scheich H. 2010. Simultaneous EEG and fMRI of the human auditory system. in EEG - fMRI: Physiological Basis, Technique, and Applications. Springer. S. 385-399. https://doi.org/10.1007/978-3-540-87919-0_19
Metzger CD, Eckert U, Steiner J, Sartorius A, Buchmann JE, Stadler J, Tempelmann C, Speck O, Bogerts B, Abler B, Walter M. 2010. High field fMRI reveals thalamocortical integration of segregated cognitive and emotional processing in mediodorsal and intralaminar thalamic nuclei. Frontiers in Neuroanatomy. 4(NOV). https://doi.org/10.3389/fnana.2010.00138
Noesselt T, Tyll S, Boehler CN, Budinger E, Heinze HJ, Driver J. 2010. Sound-induced enhancement of low-intensity vision: Multisensory influences on human sensory-specific cortices and thalamic bodies relate to perceptual enhancement of visual detection sensitivity. Journal of Neuroscience. 30(41):13609-13623. https://doi.org/10.1523/JNEUROSCI.4524-09.2010
Steinke H, Hammer N, Slowik V, Stadler J, Josten C, Böhme J, Spanel-Borowski K. 2010. Novel insights into the sacroiliac joint ligaments. Spine. 35(3):257-263. https://doi.org/10.1097/BRS.0b013e3181b7c675
Thomas U, Kobler O, Gundelfinger ED. 2010. The Drosophila larval neuromuscular junction as a model for scaffold complexes at glutamatergic synapses: Benefits and limitations. Journal of Neurogenetics. 24(3):109-119. https://doi.org/10.3109/01677063.2010.493589
Wittenbrink N, Weber TS, Klein A, Weiser AA, Zuschratter W, Sibila M, Schuchhardt J, Or-Guil M. 2010. Broad volume distributions indicate nonsynchronized growth and suggest sudden collapses of germinal center B cell populations. Journal of Immunology. 184(3):1339-1347. https://doi.org/10.4049/jimmunol.0901040
- Drittmittelprojekte
Drittmittelprojekte
2023-2028
NFDI4BIOIMAGE - Nationale Forschungsdateninfrastruktur für Mikroskopie and Bildanalyse. Task Area 3: Multimodale Datenverknüpfung und -integration. (Stöter, Zuschratter)
nfdi4bioimage.de2022-2024
Leibniz Cooperative Excellence: "Learning Resilience: Supporting neuronal network state transitions to foster stress resilience" WP 3 Brain-wide network state transitions associated with cognitive flexibility in the framework of stress resilience. (Budinger, Goldschmidt)2021-2025
DFG SFB 1436 "Neural Resources of Cognition", TP B06 “Mobilisation of neural resources for temporal attention” (Budinger, Noesselt, Pakan)
www.iknd.ovgu.de/SFB+1436.html2021-2024
DFG „Lateralisierung und Hemisphäreninteraktion bei auditorischer Verarbeitung in Kindern mit ADHS” (Angenstein)BMBF "Verbundprojekt: Time resolved Raman- und Metabolic Imaging Spektroskopie-Untersuchungen zur Detektion, Identifikation und Behandlungskontrolle mikrobieller Aktivität bei chronischer Inflammation und Kanzerogenese (TIRAMISU) - Teilvorhaben: Erforschung und Evaluierung eines zeitlich hochauflösenden hybriden Kamerasystems" (Zuschratter)
2020-2022
CBBS NeuroNetzwerk „Nicht-invasive Tiefenhirnstimulation für motorische Erkrankungen (NeeMo)“ (Budinger, Carius, Ruhnau)
2019-2021
DFG „Neuronale, behaviorale und psychophysiologische Korrelate von Programmverständnis“ (Brechmann, Siegmund)
2018-2021
DFG „Multimodale Affekterkennung im Verlaufe eines tutoriellen Lernexperiments“ (Brechmann, Schwenker)
2010-2021
DFG SFB 854 „Molekulare Organisation der zellulären Kommunikation im Immunsystem“, TP Z01 „Multimodale Bildgebungsplattform“ (Zuschratter, Dudeck, Müller)
www.sfb854.de/
2018-2020
EU EFRE „Intentionale Antizipatorische Interaktive Systeme“ TP2 „Hirnmechanismen der Informationsverarbeitung in Dialogen“ (Brechmann)
2017-2020
EU Horizon 2020: Corbel gemeinsam genutzte Dienste in den Lebenswissenschaften: „Funktionelle 3D Analyse von Immunsynapsen“, PID 2376 (Zuschratter)
2016-2020
BMWi Exist Forschungstransfer: Photonscore – ultraempfindliche und ultraschnelle Forschungskamera, FKZ Exist 03EFGST025 (Prokazov, Turbin, Zuschratter)
BMWi Exist Förderphase I: 2016 -2017: BMWi Exist Förderphase II:2018-2020EU ESF „ABINEP - Analyse, Bildgebung und Modellierung neuronaler und inflammatorischer Prozesse“, Modul 1: Neuroinflammation: Inflammatorische Prozesse und Neurodegeneration; Projekt 2: „Entwicklung neuer Techniken für die Darstellung neuroinflammatorischer Prozesse während Infektion und autoimmuner Krankheiten des Gehirns“ (Budinger, Goldschmidt, Gopola, Schlüter)
www.abinep.ovgu.de
2016-2019
DFG „Verstehen von Programmverständnis im Zeitalter der bildgebenden Verfahren“ (Brechmann, Siegmund)DFG SFB 779, Projekt B13 “Emotionale Aspekte des ereignisbasierten Lernens in Ratten: Charakterisierung und neuronale Basis” (Fendt, Goldschmidt)
www.sfb779.de
2012-2019
DFG „Combinatorial NeuroImaging Gerätezentrum“ (Brechmann, Zuschratter)
2011-2019
DFG „Hemisphäreninteraktion bei lateralisierter akustischer Verarbeitung beim Menschen: Effekte von Aufgabenschwierigkeit, Training und Alter“ (Angenstein)
2016-2018
Europäischer Fonds für regionale Entwicklung (EFRE) und Land Sachsen-Anhalt (LSA): „Ansiedlung eines 9,4T Kleintier-Magnetresonanztomographen“ (LIN unter Beteiligung von CNI Mitgliedern)
europa.sachsen-anhalt.de/esi-fonds-in-sachsen-anhalt/esi-fonds-in-sachsen-anhalt
2015-2018
BMBF-Network „EmoAdapt“ TP „Dispositionsadaptive Nutzerunterstützung auf Basis von Hirnaktivität und Psychobiologie“ (Brechmann)
2009-2017
DFG SFB-TRR 62 „Eine Companion-Technologie für kognitive technische Systeme“, TP B2 „Neuronale Mechanismen der Informationsverarbeitung in Dialogen“ (Brechmann, Scheich)
2005-2017
DFG SFB-TRR 31 „Das aktive auditorische System“, TP A4 „Prädiktive Mechanismsmen bei aktiver Stream Segregation und verwandten Aufgaben“ (Brechmann, Brosch, Scheich)
2013-2016
BMBF VIP Projekt „201TlDDC-SPECT zur Frühdiagnostik dementieller Erkrankungen“ (FKZ 03V076) (Goldschmidt)BMBF Verbundprojekt: Minimalinvasive Multiparameter-Weitfeld-Mikroskopie (T-Cam4Life)- Teilvorhaben: Erforschung und Evaluierung von Multianoden-Kamerasystemen ", FKZ 13N12675 (Zuschratter)
2013-2014
BMBF Forschungscampus STIMULATE „Photonendetektion“, FKZ 03FO16101C (Zuschratter, Prokazov, Turbin )
2012-2013
EFRE „Beschaffung eines 3 Tesla Magnetresonanztomographsystems“
2009-2013
DFG SFB Transregio 31 „Das aktive auditorische System“. TP A13: „Funktionelle Anatomie interhemisphärischer und thalamischer Interaktionen des auditorischen Kortex“ (Budinger)
2009-2013
BMBF „Magdeburger Institut für Demenzforschung (MID)”, Projekt „Kategorie-Training in normalen und kognitiv beeinträchtigten älteren Probanden” (Scheich, Brechmann)
2009-2012
BMBF Verbundprojekt: Quantum, Teilvorhaben: Erforschung und Evaluierung eines ultrasensitiven, zeitauflösendem Kamerasystems, FKZ: 13N10077 (Zuschratter)DFG SFB-TRR 31 „Das aktive auditorische System“, TP A12 „Dopaminerge Modulation lernabhängiger Plastizität im Hörkortex“ (Thiel, Brechmann)
2009-2010
DAAD Austausch-Programm 313-PPP.SF.09-lk: „Identifikation von Synapsen im lateralen Septum der Ratte positiv für den vesikulären Glutamattransporter 3“ (Budinger, Miettien, Riedel)
2008-2010
LSA, EU „Neurobiologisch inspirierte, multimodale Intentionserkennung für technische Systeme“, Projekt „Mechanismen der Prosodieverarbeitung in Dialogen“ (Scheich, Brechmann)
2007-2010
BMBF-Verbund „Wie unterscheidet das Gehirn zwischen Prosodie und Gesang?“, Projekt „Auditorische Verarbeitung von Prosodie und Gesang“ (Scheich, Brechmann) - Transfer
LINCam: Entwicklung einer ultra-sensitiven, zeitauflösenden Forschungskamera für die funktionelle Bildgebung (Yury Prokazov, Evgeny Turbin, André Weber, Werner Zuschratter)
Neben der räumlichen und zeitlichen Auflösung stellt die Empfindlichkeit des Detektors die größte Herausforderung bei der mikroskopischen Untersuchung lebender Zellen und Gewebe dar. Unter Berücksichtigung der Tatsache, dass alle vorhandenen Mikroskopsysteme lebende Proben enorm belasten, haben wir ein minimal-invasives Bildgebungssystem zur Visualisierung von Biosensoren in nativen Zellen und Geweben entwickelt. Die technische Realisierung führte zu einem patentierten und preisgekrönten hochempfindlichen, zeitaufgelösten Quantendetektor mit einem breiten Anwendungsbereich. Das Kamerasystem wurde bereits erfolgreich in mehreren Forschungsprojekten für FLIM- und FRET-Messungen von Biosensoren (Stirnweiss et al. 2013; Philipson et al. 2017), aber auch zur Bestimmung von pH- und Ca2+ -Sensoren, markierungsfreier metabolischer Bildgebung (Weber et al., 2017), Einzelmoleküldetektion (Oleksiievets et al., 2020), Quantenoptik und Raman-Spektroskopie (Konugolu et al., 2018) eingesetzt. Da das Kamerasystem ein großes Marktpotential aufweist, wurde 2017 das Spin-off „Photonscore GmbH“ gegründet, das die Technologie seitdem erfolgreich unter dem Namen „LINCam“ vermarktet.
Abbildung: Kameramodule der LINCam25 and LINCam40Abbildung: LINCam an einem Leica Lightsheet Mikroskop
Förderung:- BMBF TCAM4Life (FKZ: 13N12675)
- BMWi EXIST (FKZ: 03EFGST025)
- Lehre
Lehre
Lehre & Praktika
Wir betreuen sowohl Praktika als auch Bachelor-, Master- und Doktorarbeiten. Bei Interesse nehmen Sie bitte Kontakt mit uns auf!
Wir halten regelmäßig Vorlesungen und Seminare für Studierende des Master-Studiengangs "Integrative Neuroscience", des Master-Studiengangs Psychologie, des Bachelor-Studiengangs Philosophy, Neurowissenschaften, Kognition und des Bachelor-Studiengangs Informatik.
Darüber hinaus führen wir Workshops zur Bildanalyse durch und halten in Zusammenarbeit mit der Neurowissenschaftlichen Gesellschaft (NWG) jährlich Kurse zur funktionellen Organisation von Synapsen ab.
Spezifische Kurse:
- MicroImaging, Vorlesung und Praktikum im Master-Studiengang Integrative Neuroscience
- Macroimaging, Vorlesung im Master-Studiengang Integrative Neuroscience
- Advanced Statistics for Neuroscience, Vorlesung und Übung im Master-Studiengang Integrative Neuroscience
- Neuroanatomie, Vorlesung im Master-Studiengang Psychologie
- Einführung in das Nervensystem, Vorlesung im Bachelor-Studiengang Philosophy, Neurowissenschaften, Kognition
- Neurobiologische Lernforschung, Seminar- und Laborrotation im Bachelor-Studiengang Informatik, Lernsysteme / Bioinformatik
- Summerschool des Bachelor-Studiengangs Informatik, Lernsysteme / Bioinformatik