AG Hippocampus-Plastizität und episodisches Gedächtnis
Die Fähigkeit, vergangene Erfahrungen zu speichern und bewusst abzurufen, ist entscheidend für das Überleben und die Schaffung eines kohärenten Realitätssinns. Diese Fähigkeit hängt bei Säugetieren von der Hippocampus-Formation ab, die Erfahrungen durch koordinierte neuronale Aktivität kodiert. Wir wollen die zellulären und schaltungstechnischen Mechanismen untersuchen, die der Fähigkeit des Hippocampus, Erinnerungen zu erwerben und abzurufen, zugrunde liegen. Wir verwenden die intravitale optische Bildgebung, um die neuronale synaptische Plastizität und die neuronalen Aktivitätsmuster zu untersuchen, die der Repräsentation von Erfahrungen im Hippocampus von lebenden Mäusen zugrunde liegen, die Lernaufgaben durchführen. Wir nutzen molekulare und genetische Werkzeuge, um definierte Synapsen zu untersuchen und die Aktivität spezifischer neuronaler Populationen zu manipulieren. Diese Instrumente ermöglichen es uns, die zellulären Vorgänge im Hippocampus zu untersuchen, die dem Lernen und Abrufen von Erfahrungen zugrunde liegen, wobei wir von molekularen Mechanismen bis hin zur Berechnung auf Netzwerkebene gehen.
Weitere Informationen gibt es hier.
- Leiter
Leiter

Alessio Attardo ist Neurobiologe, der sich dafür interessiert, wie Neuronen Informationen speichern und berechnen. Er interessiert sich dafür, wie Netzwerke von Neuronen im Gehirn Erinnerungen erwerben und abrufen.
Nach Abschluss seines Biologiestudiums an der Universität Palermo (Italien) wechselte er 2002 an das Max-Planck-Institut für Zellbiologie und Genetik in Dresden, wo er unter der Leitung von Wieland B. Huttner seine Doktorandenausbildung begann. Während dieser Zeit beschrieb er die Abstammung der Vorläuferzellen, die die Hauptquelle der Neuronen im Neokortex von Säugetieren bilden. Im Jahr 2008 ging er als Postdoktorand nach Kalifornien (U.S.A.). An der Stanford University entwickelte er unter der Leitung von Mark J. Schnitzer eine neuartige chronische optische Bildgebungstechnik für das Tiefenhirn zur Untersuchung der Langzeitplastizität von Pyramidenneuronen im Hippocampus lebender Mäuse. Im Jahr 2015 gründete er seine eigene unabhängige Forschungsgruppe in der Abteilung für Stressneurobiologie und Neurogenetik am Max-Planck-Institut für Psychiatrie in München (Deutschland), die sich auf strukturelle Plastizität in Hippocampus-Neuronen als zelluläre Grundlage des Gedächtnisses und auf die Auswirkungen von Stress auf strukturelle Plastizität und neuronale Repräsentationen konzentriert.
Seit Januar 2022 leitet Alessio Attardo seine Gruppe in der Abteilung Zelluläre Neurowissenschaften am LIN.
- Mitglieder
Mitglieder
Leiter Dr. Alessio Attardo +49-391-6263-93371 alessio.attardo@lin-magdeburg.de Wissenschaftliche Mitarbeiter Dr. Leonid Fedorov +49 391 6263 93371 leonid.fedorov@lin-magdeburg.de Dr. Hadi Mirzapourdelavar +49-391-6263-93351 hadi.mirzapourdelavar@lin-magdeburg.de Doktoranden Hannah Klimmt +49-391-6263-93351 hannah.klimmt@lin-magdeburg.de Bhargavi Keerthana Boovaraga Murthy +49-391-6263-93351 bhargavi.murthy@lin-magdeburg.de Stefanos Somatakis +49 391 6263 92411 stefanos.somatakis@lin-magdeburg.de Alumni Lasse Büchen Akilashree Senthilnathan Alessandro Ulivi - Forschungsschwerpunkte
Forschungsschwerpunkte
Synaptische Plastizität und Gedächtnis
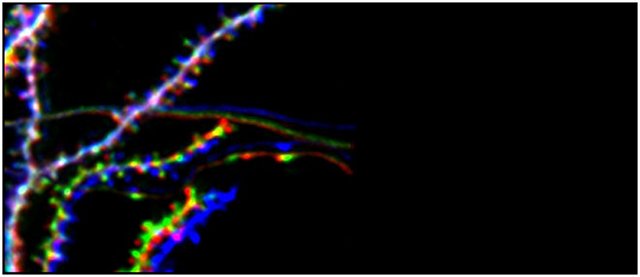
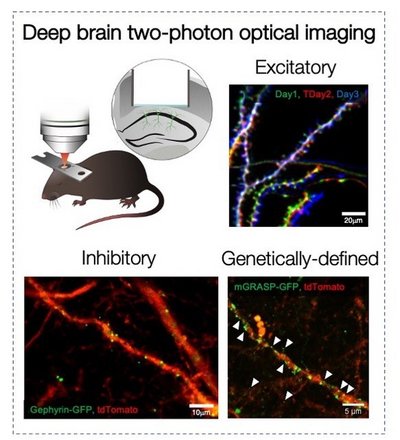
Es wird allgemein angenommen, dass Synapsen ein grundlegendes Substrat des Gedächtnisses sind. Während im Neokortex die Zwei-Photonen-Bildgebung Licht auf die Beziehung zwischen Lernen und synaptischem Umsatz wirft, ist eine solche Beziehung im Hippocampus noch unklar. Wir wollen eine direkte Verbindung zwischen synaptischer Plastizität und Lernen im CA1 des Hippocampus von lebenden Tieren herstellen und untersuchen, wie Stress diese Funktion beeinflusst. Zu diesem Zweck verwenden wir die optische Bildgebung von dendritischen Dornen im basalen Teil des Hippocampus CA1 (Attardo et al., 2015; Ulivi et al., 2019 und Castello-Waldow et al., 2020), um den langfristigen synaptischen Umsatz bei lebenden Tieren zu untersuchen, die eine Gedächtnisaufgabe lernen, die den Hippocampus erfordert.Neuronale Repräsentationen und Gedächtnis
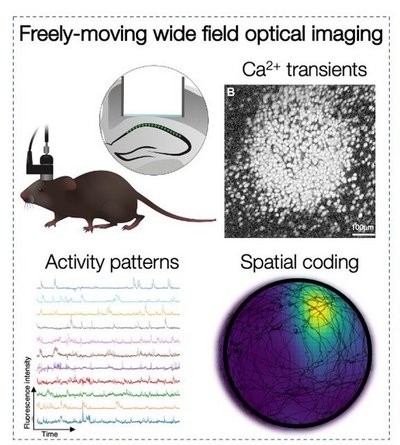
Erregende und hemmende Neuronen repräsentieren räumliche und nicht-räumliche Informationen durch ihre Aktivitätsmuster im CA1 des Hippocampus. Wie kommen diese Muster zustande? Welche Funktion haben sie beim Lernen und Abrufen? Wie werden sie durch Stress verändert? Um diese und weitere Fragen zu beantworten, verwenden wir Mikroskope, die dauerhaft am Kopf der Maus angebracht werden können, um die Aktivität von Hunderten von CA1-Neuronen aufzuzeichnen, während die Mäuse vom Hippocampus abhängige Gedächtnisaufgaben ausführen. - Drittmittelprojekte
Drittmittelprojekte
2024-2027
DFG research grant
AT205/18-1: “Stability of synaptic memory engram“
2021-2024
DFG research grant
AT205/10-1: “How does activity of CA3 engram neurons affect CA1 spatial codes?“
2021-2024
DFG research grant
AT205/9-1: “Maintaining Activity Set-Points in the Hippocampus: From Long-Term Dynamics of Excitatory and Inhibitory Synapses to Functional Stability of CA1 Circuits“
2020-2023
DFG research grant
AT205/7-1: “The impact of neuronal activity on functional re wiring of hippocampal CA1 excitatory neurons”
2017-2020
Schram foundation research grant
T287/29575/2017: “Determining the function of local inhibitory circuits in the synaptic dynamics of hippocampal pyramidal neurons during learning and memory”
2017-2020
DFG research grant
AT205/1-1: “Investigating the effects of chronic stress on hippocampal representations, synaptic connectivity and learning” - Publikationen
Publikationen
Learning to become addicted, one synapse at a time. Attardo A, Cambridge SB. Neural Regen Res. 2024 Feb;19(2):401-402. 10.4103/1673-5374.379046
Arc-driven mGRASP highlights CA1 to CA3 synaptic engrams. Murthy BKB, Somatakis S, Ulivi AF, Klimmt H, Castello-Waldow TP, Haynes N, Huettl RE, Chen A, Attardo A. Front Behav Neurosci. 2023 Jan 30;16:1072571. 10.3389/fnbeh.2022.1072571. eCollection 2022
Repeated stress exposure leads to structural synaptic instability prior to disorganization of hippocampal coding and impairments in learning. Chenani A, Weston G, Ulivi AF, Castello-Waldow TP, Huettl RE, Chen A, Attardo A. Transl Psychiatry. 2022 Sep 12;12(1):381. 10.1038/s41398-022-02107-5.
Hippocampal neurons with stable excitatory connectivity become part of neuronal representations. Castello-Waldow TP, Weston G, Ulivi AF, Chenani A, Loewenstein Y, Chen A, Attardo A. PLoS Biol. 2020 Nov 3;18(11):e3000928. https://doi.org/10.1371/journal.pbio.3000928
Longitudinal Two-Photon Imaging of Dorsal Hippocampal CA1 in Live Mice. Ulivi AF, Castello-Waldow TP, Weston G, Yan L, Yasuda R, Chen A, Attardo A. J Vis Exp. 2019 Jun 19;(148). 10.3791/59598
Long-Term Consolidation of Ensemble Neural Plasticity Patterns in Hippocampal Area CA1. Attardo A, Lu J, Kawashima T, Okuno H, Fitzgerald JE, Bito H, Schnitzer MJ. Cell Rep. 2018 Oct 16;25(3):640-650.e2. https://doi.org/10.1016/j.celrep.2018.09.064
Impermanence of dendritic spines in live adult CA1 hippocampus. Attardo A, Fitzgerald JE, Schnitzer MJ. Nature. 2015 Jul 30;523(7562):592-6. 10.1038/nature14467. Epub 2015 Jun 22.
Time-lapse imaging of disease progression in deep brain areas using fluorescence microendoscopy. Barretto RP, Ko TH, Jung JC, Wang TJ, Capps G, Waters AC, Ziv Y, Attardo A, Recht L, Schnitzer MJ. Nat Med. 2011 Feb;17(2):223-8. https://doi.org/10.1038/nm.2292. Epub 2011 Jan 16.
Tis21 expression marks not only populations of neurogenic precursor cells but also new postmitotic neurons in adult hippocampal neurogenesis. Attardo A, Fabel K, Krebs J, Haubensak W, Huttner WB, Kempermann G. Cereb Cortex. 2010 Feb;20(2):304-14. https://doi.org/10.1093/cercor/bhp100. Epub 2009 May 29.
Intermediate neuronal progenitors (basal progenitors) produce pyramidal-projection neurons for all layers of cerebral cortex. Kowalczyk T, Pontious A, Englund C, Daza RA, Bedogni F, Hodge R, Attardo A, Bell C, Huttner WB, Hevner RF. Cereb Cortex. 2009 Oct;19(10):2439-50. https://doi.org/10.1093/cercor/bhn260. Epub 2009 Jan 23.
Cytokinesis of neuroepithelial cells can divide their basal process before anaphase. Kosodo Y, Toida K, Dubreuil V, Alexandre P, Schenk J, Kiyokage E, Attardo A, Mora-Bermúdez F, Arii T, Clarke JD, Huttner WB. EMBO J. 2008 Dec 3;27(23):3151-63. https://doi.org/10.1038/emboj.2008.227. Epub 2008 Oct 30.
Live imaging at the onset of cortical neurogenesis reveals differential appearance of the neuronal phenotype in apical versus basal progenitor progeny. Attardo A, Calegari F, Haubensak W, Wilsch-Bräuninger M, Huttner WB. PLoS One. 2008 Jun 11;3(6):e2388. https://doi.org/10.1371/journal.pone.0002388.
Identification of midbrain floor plate radial glia-like cells as dopaminergic progenitors. Bonilla S, Hall AC, Pinto L, Attardo A, Götz M, Huttner WB, Arenas E. Glia. 2008 Jun;56(8):809-20. https://doi.org/10.1002/glia.20654
The Rho-GTPase cdc42 regulates neural progenitor fate at the apical surface. Cappello S, Attardo A, Wu X, Iwasato T, Itohara S, Wilsch-Bräuninger M, Eilken M, Schroeder T, Huttner W, Brakebusch C, Götz M. Nat Neurosci. 2006 Sep;9(9):1099-107. Epub 2006 Aug 6. 10.1038/nn1744
Neurons arise in the basal neuroepithelium of the early mammalian telencephalon: a major site of neurogenesis. Haubensak W, Attardo A, Denk W, Huttner WB. Proc Natl Acad Sci USA. 2004 Mar 2;101(9):3196-201. Epub 2004 Feb 12. https://doi.org/10.1073/pnas.0308600100